متغیرهای مرتبط با کلسیفیکاسیون و پوستاندازی

متغیرهای مرتبط با کلسیفیکاسیون و پوستاندازی
pH محیطی یک عامل مهم موثر بر سختپوستان است(پان و همکاران، 2007). در استخرهای آبزیپروری، مقادیر pH میتوانند از 6/6 تا 10/2 نوسان کنند و این تغییر در pH غالباً توسط تنفس میگو، فرایندهای بیوشیمیایی مختلف از جمله فتوسنتز/تنفس فیتوپلانکتونها و زئوپلانکتونها و ترکیب میکروبی بقایای آلی تعدیل میشود که ممکن منجر به استرس در پی.وانامی شود(بوید، 1990؛ چن و همکاران، 2018؛ داتا، 2012). پس از غروب آفتاب، غلظتهای DO با توقف فتوسنتز کاهش مییابد و تمامی گیاهان و حیوانات در استخر به مصرف اکسیژن ادامه میدهند(تنفس). در استخرهای با تراکم سنگین، غلظتهای CO2 میتوانند در نتیجه تنفس افزایش یابند. CO2 آزاد رها شده در طی تنفس با آب واکنش میدهد و کربنیک اسید را تولید میکند که به سرعت جدا میشود تا یونهای هیدروژن(H+، که باعث کاهش در pH میشود) و یونهای بیکربنات شکل بگیرد.
زمانی که pH محیطی به خارج از دامنه بهینه افت میکند(جدول 11.3 را ببینید)، میگوها ممکن است دچار اختلال فیزیولوژیکی ناشی از اختلال در تعادل یونی داخلی شوند، که میتواند متعاقب آن منجر به رشد کند، رفتار غیرعادی و افزایش مرگ و میر شود(هان و همکاران، 2018) و فعالیت ایمنی را سرکوب کرده(پانگ و جیانگ، 2002) و آسیب اکسیداتیو وارد کند(وانگ و همکاران، 2012).
قلیائیت کل، ظرفیت بافر اسید آب، و توانایی حفظ یک pH پایدار برای هر افزایش مشخص است؛ برای مثال، عمدتاً ناشی از افزایش در CO2 رخ میدهد. در بیشتر آبهای طبیعی(شیرین و شور)، بخش اعظم قلیائیت کل از یونهای کربنات و بیکربنات گرفته شدهاست که بصورت جمعی بعنوان قلیائیت کربنات شناخته میشود. به لحاظ کمی، بصورت زیر محاسبه میشود:
Carbonate alkalinity = [HCO3–] + 2[CO32-] – Eq. 9
به همین دلیل است که هر یون کربنات میتواند افزودن دو یون H+ قبل از تبدیل شدن به CO2 را بافر کند، در حالی که هر یون بیکربنات تنها با یک یون H+ در طی تبدیل به CO2 واکنش میدهد. در آب دریا، قلیائیت کل شامل مقادیر کوچکتر سایر مولفههای بافر اسید مانند بورات، هیدروکسید، فسفات، سیلیکات و اسیدها و بازهای آلی جزئی تراوش کرده از فیتوپلانکتونها است که آخرین مورد آنها 10 درصد قلیائیت کل را به خود اختصاص دادهاست(ای.فرر، نتایج منتشرنشده). در محیطهای آبزیپروری، قلیائیت عموماً برحسب میلیگرم بر لیتر بصورت کلسیم کربنات(میلیگرم بر لیتر CaCO3، میلیگرم CaCO3 بر لیتر) گزارش میشود که مبتنی بر این فرض است که قلیائیت کل تنها برگرفته از قلیائیت کربنات است و اینکه تمامی آن برگرفته از انحلال نظری کربنات کلسیم خالص جامد است. طبق ون وایک و اسکارپا(1999)، قلیائیت بیش از 100 میلیگرم بر CaCO3 بر لیتر برای رشد پی.وانامی ایدهآل است و مقادیر بالاتر دامنه نوسانات روزانه pH را کاهش میدهند. تیمونز و ابلینگ(2013) بهبود عملکرد در پی.وانامی تحت سطوح CaCO3 در دامنه 140 تا 180 میلیگرم بر لیتر را نشان دادند که ممکن است به بهبود موجودی کلسیفیکاسیون سریع پس از پوستاندازی ارتباط داشتهباشد.
در استخرهای میگو، pH با افزودن یک ماده قلیایی تثبت میشود. این امر با استفاده از ترکیبات مختلف کربنات، بیکربنات، اکسید یا هیدروکسید برای افزایش pH آب تولید انجام میشود که منجر به افزایش ظرفیت بافر با افزایش قلیائیت کربنات میشود.
جدول 11.3. سطوح بهینه توصیه شده برای pH، قلیائیت و CO2 برای پرورش پی.وانامی
| متغیر | مرحله حیات | نقطه پایانی | واحد | منابع |
| CO2 | میگوهای نوجوان(1/76 گرم) | LC50 96 ساعته | کمتر از 5/9 میلیگرم بر لیتر | فورتادو و همکاران، 2017
|
| CO2 | میگوهای نابالغ(12/1 گرم) | مصرف اکسیژن
| کمتر از 5 میلیگرم بر لیتر | فورتادو و همکاران، 2016 |
| CO2 | میگوهای نابالغ(6 گرم) | افزایش وزن، بهرهوری، زیست توده، نرخ تبدیل غذا | کمتر از 5/38 میلیگرم بر لیتر | فورتادو و همکاران، 2011 |
| pH | میگوهای نوجوان(1/2 گرم) | بقا؛ رشد(وزن و طول) | بیشتر از pH 6/7 کمتر از pH 9/7 | هان و همکاران، 2018 |
| pH | میگوهای نوجوان(3/2 گرم) | مورفولوژی دستگاه گوارش؛ کارکرد ایمنی؛ دفاع آنتی اکسیدانی | بیشتر از pH 6/7 کمتر از pH 9/7 | دوان و همکاران، 2019 |
| pH | میگوهای نابالغ(7 تا 8 گرم) | گونه اکسیژن واکنشی؛ سرکوب کاتالاز؛ غلظت مالون دی آلدهید[1] | بیشتر از pH 6/7 کمتر از pH 9/3 | وانگ و همکاران، 2012 |
| pH | پستلارو(PL10) | LC50 96 ساعته حاد | بیشتر از pH 4/04 کمتر از pH 9/58 | فورتادو و همکاران، 2015 |
| pH | نابالغ(10/2 گرم) | حساسیت به وی.الجینولیتیکوس؛ پاسخ ایمنی | بیشتر از pH 6/5 کمتر از pH 10/1 | لی و چن، 2008 |
| pH | نابالغ(6 گرم) | افزایش وزن، بهرهوری؛ زیست توده، FCR | بیشتر از pH 7/5 | فورتادو و همکاران، 2011 |
| قلیائیت | میگوهای نوجوان(0/2 گرم) | فرایند نیتریفیکاسیون(در بیوفلاک)، رشد | بزرگتر مساوی با 150 میلیگرم بر CaCO3 بر لیتر | فورتادو و همکاران، 2015 |
| قلیائیت | نابالغ(6 گرم) | افزایش وزن، بهرهوری؛ زیست توده، FCR | بزرگتر از 100 میلیگرم بر CaCO3 بر لیتر | فورتادو و همکاران، 2011 |
برخی مولفههای قلیائی متفاوت مورد استفاده، مستقیماً قلیائیت کربنات را افزایش میدهد، مانند سدیم بیکربنات[2]، پتاسیم بیکربنات[3]، سدیم کربنات[4]، پتاسیم کربنات[5] و کلسیم کربنات. با این وجود، سایر مواد قلیائی که به کار میروند pH را بصورت مستقیم افزایش میدهند، اما تنها در وهله بعد قلیائیت کربنات را در نتیجه تغییر در pH در تبدیل CO2 محلول موجود به یونهای HCO3– و CO32- (مانند سدیم هیدروکسید[6]، کلسیم هیدروکسید[7]، کلسیم اکسید، و منیزیم اکسید) افزایش میدهند. مواد قلیائی مورد استفاده دارای خصوصیات مختلفی برحسب انحلالپذیری، قدرت واکنش(تغییر pH موثر)، و ایمنی در جابجایی هستند که باید برای استفاده در محیطهای آبزیپروری متراکم مدنظر قرار بگیرند(ویسلسکی و همکاران، 2015). علاوه بر این، موجودی و هزینه ترکیبات مختلف قلیائی به لحاظ منطقهای متفاوت است، و لذا مطلوبیت اشکال مختلف برای کاربرد در محیطهای خاص باید به شیوهای خاص آن زمینه در زمان تعیین بهترین رویه برای کنترل قلیائیت و pH در سطح مزرعه تعیین گردد.
کربن دی اکسید یک پارامتر بسیار مهم محدودکننده کیفیت آب است که عمدتاً نادیده گرفته شدهاست و عمدتاً با چالش فنی اندازهگیری آن در محلول و فقدان تجهیزات قوی، دقیق، مطمئن و مقرون به صرفه برای اندازهگیری این پارامتر در محل در یک محیط تجاری روبرو است. علاوه بر این، این چالش با این واقعیت نیز همراه است که وقتی CO2 در آب حل میشود به اولین شکل کربنیک اسید واکنش میدهد، قبل از اینکه برای تشکیل یونهای H+ و بیکربنات تجزیه شود. این واکنش رفع چالش افزایش CO2 را حتی از پر کردن دوباره اکسیژن دشوارتر میسازد، علیرغم اینکه رابطه تناسب عکسی بین حذف O2 و تولید CO2 به وسیله تنفس وجود دارد.
در بخش متغیرهای مرتبط با کلسیفیکاسیون، مسئله کلیدی که شرح داده میشود این است که چرا ویژگیهای فیزیکی شیمیایی دو گاز تنفسی به این معناست که کربن دی اکسید بسیار آرامتر از جایگزینی اکسیژن حذف میشود. این مطلب شامل این دلیل است که چرا استفاده از اکسیژن خالص(رویه رایج در RAS برای کاهش خطر اکسیژنزدائی) مسئله تجمع CO2 در پرورش میگو را تشدید میکند. این پارامتر که به درستی درک نشدهاست میتواند اثرات چشمگیر و اغلب دچار تشخیص غلط در یک محیط متراکم داشتهباشد. علاوه بر این، زمانی که زیست توده افزایش مییابد، چالش افزایش CO2 نیز متناسب با آن تشدید میشود. در سیستمهای گسترده یا نیمه متراکم، سطح هوادهی اغلب برای حذف CO2 کافی از آب و کنترل این پارامترها تا سطوح نزدیک به تعادل جو کافی است. با این وجود، در سیستمهای فوق متراکم که زیست توده میگو میتواند از 15 کیلوگرم بر مترمربع فراتر برود و حذف پسماند نیتروژندار از باکتریهای هتروتروفیک و شورهسازها برای اکسیداسیون نیتریت و آمونیاک استفاده میکند(به ترتیب AOB و NOB)، واحدهای گاززدائی مازاد برای کنترل آن لازم هستند.
محصولات دفعی نیتروژندار(آمونیاک، نیتریت و نیترات)
آمونیاک، نیتریت و در درجه کماهمیتتر، نیترات، گونههای واکنشی نیتروژن هستند که آلایندههای محیطی عمده در سیستم آبزیپروری به شمار میروند و اگر در دامنه بهینه حفظ نشوند، برای ارگانیسمهای آبزی مضر خواهند بود(جدول 11.4 را ببینید). آمونیاک محصول انتهایی اصلی کاتابولیسم پروتئین در چرخه نیتروژن است، در حالی که نیتریت یک محصول میانی در فرایند نیتریفیکیاسیون تبدیل آمونیاک به نیترات است. تجمع آمونیاک و نیتریت، و حدود کمتر نیترات، منجر به افت کیفیت آب در مخازن/استخرهای میگو میشود، چنانچه در بخش متغیرهای مرتبط با کلسیفیکاسیون به آن پرداخته شد، و علت اصلی کاهش رشد، سرکوب ایمنی و حساسیت به پاتوژن در میگوها به شمار میرود.
بنابراین، غلظت آمونیاک باید به نحو ایدهآل نزدیک به مقادیر بهینه(کمتر از 1/1 میلیگرم بر لیتر، معادل تقریباً 0/12 میلیگرم بر لیتر NH3-H در pH 7/5 تا 8/2) حفظ شود. در استخرهای بیرونی(نیمه متراکم یا متراکم)، این مقدار میتواند بسته به شدت تغذیه میگوها متغیر باشد، اما معمولاً توسط اتوتروفهای نوری کنترل میشود. در سیستمهای داخلی، آمونیاک عمدتاً به وسیله هتروتروفها و شورهسازها بسته به خصوصیات پرورش سیستم کنترل میشود.
چندین روش برای کنترل آمونیاک و متعاقب آن کنترل افزایش نیترات و نیتریت وجود دارد، چنانچه این فرایندها توسط باکتریهای اکسیدکننده آمونیاک[8] و باکتریهای اکسیدکننده نیتریت[9] بهم پیوند میخورند. استراتژیهای مورد استفاده برای مدیریت این محصولات نیتروژندار عمدتاً بر مدیریت تغذیه متمرکز هستند. غذاها معمولاً حاوی مقادیر بالای پروتئین با ترکیب غذایی خاص و محتوی پروتئین وابسته به مرحله تولید میگوها هستند(یعنی، میگوهای نوجوان نیازمند غذایی با محتوای پروتئین نزدیک به 50 درصد هستند، در حالی که میگوهای نابالغ نیازمند غذاهایی با محتوای پروتئین 35 درصد هستند). زمانی که آمونیاک از مقادیر بهینه فراتر میرود، و هیچ وسیلهای برای مدیریت آن وجود ندارد، تعویض آب یکی از رایجترین و سریعترین شیوههای مورد استفاده توسط پرورشدهندگان است که با شستوشوی درصدی از آب(30 تا 50 درصد) از استخر حاصل میشود که با آب شیرین پر میشود و غلظت آمونیاک از طریق رقیقسازی کاهش مییابد.
نیتریت از طریق نیتریفیکاسیون اکسیده شده و به نیترات تبدیل میشود؛ فرایندی که میانجی آن میکروب است. نرخ این واکنش تحت تاثیر تغییرات در دما، شوری و pH قرار دارد. با این وجود، در استخرهای میگوی باز، اجتماع میکروبی موجود در محیط(رسوب و زیرلایهها) به آسانی و به سرعت، نیتریت را به نیترات تبدیل میکند و لذا نیتریت اغلب به دقت در این شرایط کنترل نمیشود. بالعکس در سیستمهای داخلی، پایش دقیقتر نیتریت اغلب ضروری است، بخصوص جایی که اجتماع میکروبی وجود دارد و سپس بصورت مصنوعی حفظ میشود. در چنین سیستمهایی، توصیه میشود که سطوح نیتریت از 5/15 میلیگرم بر لیتر فراتر نرود، چنانچه این مقدار بیانگر اکسیداسیون میکروبی ناکافی نیتریت به نیترات و احتمالاً اختلال در اجتماع میکروبی است. به محض اینکه این پارامتر به سطوح بهینه نزدیک شده یا از آنها فراتر رفت، فراوانی اندازهگیری برای نیتریت نیز باید افزایش یابد و اقدامات اصلاحی فورا از طریق تعویض آب جزئی با حجم کافی اتخاذ شود تا هرگونه پیک نیتریت از طریق رقیقسازی برطرف شود.
جدول 11.4. سطوح بهینه توصیه شده از محصولات نیتروژندار برای پرورش پی.وانامی در مراحل مختلف حیات و شوریهای متفاوت.
| متغیر | مرحله حیات | شوری(psu) | نقطه پایانی | TAN بهینه(میلیگرم بر لیتر) | NH3-N بهینه (میلیگرم بر لیتر) (pH در پرانتز) | منابع |
| TAN | نوجوانی، 0/99 و 3/8 گرم | 34 | سمیت حاد | 6/52 و 7/09 | 0/29 و 0/13(8/08) | فرایز- اسپریکوتا و همکاران، 1999 |
| TAN | پستلارو، 4 ± 9/25 میلیگرم | 34 | سمیت حاد | 1/22 | 0/048(7/92) | فرایز- اسپریکوتا و همکاران، 2000 |
| آمونیاک + نیتریت | نوجوانی، 0/02 ± 0/90 گرم | 30 تا 31 | بقا، افزایش وزن و طول، SGR | کمتر از 1/22 | کمتر از 0/05(میانه 7/85) | هان و همکاران، 2017 |
| TAN | بالغ، 0/5 ± 20 گرم | 20 | حساسیت به باکتریهای پاتوژنی | کمتر از 5/24 | کمتر از 0/25(8) | چن و لیو، 2004 |
| TAN یا NH3-N | بالغ 0/5 ± 20 گرم | 20 | انعقاد هموسیت | کمتر از 5 | کمتر از 0/357(8) | چانگ و همکاران، 2015 |
| TAN | نوجوان، 1/1 ± 10/29 گرم | 39 | تقاضای متابولیک | 2/14 | 0/02 میلی مول بر لیتر(7/8) | راکوتا و هرناندز هررا، 2000 |
| TAN | پستلارو | 35 | فروانی پوستاندازی | کمتر از 6 | کمتر از 0/23(7/8) | رستمی و همکاران، 2019 |
| TAN | Zoea 1 | 34 | سمیت حاد | 0/42 | 0/05(8/5) | دی لوردس کوبو و همکاران، 2014 |
| نیتریت(NO2-N) | نوجوان، 0/50 ± 8/0 گرم | 8 | رشد و بقا | کمتر از 2/5 | فروتادو و همکاران، 2016 | |
| نیتریت(NO2-N) | نوجوان، 0/50 ± 8/0 گرم | 24 | رشد و بقا | کمتر از 10 | فورتادو و همکاران، 2016 | |
| نیتریت – N | نوجوان، 8/4 تا 14/7 گرم | 35 | حساسیت به پاتوژنها و مرگ و میر | کمتر از 5/15 | تی سنگ و چن، 2004 | |
| نیتریت – N | نوجوان، 0/42 ± 3/96 گرم | 15 | سمیت حاد | 6/1 | چن و لی، 2003 | |
| نیتریت – N | نوجوان، 0/42 ± 3/96 گرم | 25 | سمیت حاد | 15/2 | چن و لی، 2003 | |
| نیتریت – N | نوجوان، 0/42 ± 3/96 گرم | 35 | سمیت حاد | 25/7 | چن و لی، 2003 | |
| نیتریت – N | نوجوان، 0/31 ± 1/30 گرم | 23 | رشد و بقا | 177 | فورتادو و همکاران، 2016 | |
| نیتریت – N | نوجوان، کمتر از 2/5 گرم | 11 | بقا، رشد، طول آنتن و پاتولوژی | 220 | کان و همکاران، 2010 |
سطوح نیترات باید کمتر از 200 میلیگرم بر لیتر حفظ شوند(کان و همکاران، 2010). با این وجود، دامنه بهینه چیزی کمتر از 120 میلیگرم بر لیتر NO3-N، بخصوص برای پرورش داخلی ذخیره مولدین پی.وانامی پیشنهاد میشود. مواجهه طولانی با مقادیر بالای نیترات میتوان به افزایش شیوع پوسته شل در مخازن ذخیره مولدین قرار گرفته شده در معرض سطوح نیترات بیش از 200 میلیگرم بر لیتر در طی دورههای طولانی ارتباط داشتهباشد. سندروم پوسته شل بر کارایی تبدیل غذای میگو تاثیر گذاشته و منجر به کیفیت پایین گوشت میشود و مخازن/استخرهای تاثیرگذیرفته میتوانند دچار مرگ و میرهای مزمن و بقای ضعیف شوند(راجا و همکاران، 2015).
این روند از یافتههای کان و همکاران(2010) پشتیبانی میکند که در مطالعات آنها، میگوهای قرار گرفته در معرض غلظتهای بالای نیترات در طی یک دوره زمانی طولانی، طول آنتن کوتاهتر، ناهنجاریهای آبشش و ضایعات در هپاتوپانکراس را نشان دادند. هپاتوپانکراس عضوی در میگو است که آنزیمهای گوارشی تولید میکند و مسئول ارتقای جذب نرمال غذای هضم شدهاست. در غیاب افزایش نیترات، سلولهای هپاتوپانکراتیک رقیق شده و از غشاهای اپیتلیال خالی شدند که احتمالاً پیامدی از تغذیه ناکافی یا متابولیسم ضعیف غذا باشد(کان و همکاران، 2010).
اندازهگیری پارامتر و فناوری مرتبط
پارامترهای کیفیت آب عموماً بصورت دستی به کمک روشها و ابزار مختلف اندازهگیری میشوند تا وضعیت آنها تعیین شود. شیوههای سنجش و کنترل این پارامترها و روشهای آنها بصورت گسترده توسط چندین محقق بررسی شدهاست(بوید و توکر، 1992؛ چین، 1992؛ فلیو و همکاران، 2009) و بسیاری از اندازهگیریها بصورت روزانه در پرورش میگو انجام میشوند.
اندازهگیریهای روزانه پارامتر برای خودِ شرایط در محل انجام میشوند که بازتابی از شرایط در یک مکان خاص درون یک مخزن/استخر است و یک اندازهگیری را ارائه میدهد که تنها تصویری را در زمان بدون توجه به سایر فرایندهایی که ممکن است بر توزیع فضائی زمانی پارامترها تاثیر بگذارند، ارائه میدهد(هارگریوز و توکر، 2012). استخرها/مخازن محیطهای بسیار پویایی هستند که کیفیت آب در آنجا به سرعت و به طرز غیرقابل پیشبینی تغییر میکند. بنابراین، باید به زمان و موقعیتی که اندازهگیریها در آنجا برای درک شرایط استخر انجام میشوند توجه کرد.
بنابراین، استفاده از روشهای مطمئن و قدرتمند و تجهیزات اندازهگیری کالیبره از اهمیت بالایی برخوردار است. برنامههای پایش برنامهریزی شده، که بصورت ایدهآل متناسب با مکان مشابه در استخر/مخزن و در زمانهای مشابه در هر روز انجام میشود، امکان تشخیص روندهای زمانی را فراهم ساخته و به مدیران مزرعه کمک میکنند تا هرگونه انحراف زیانآور در کیفیت آب را پیشبینی، پیشگیری و تصحیح نمایند تا شرایط بهینه در مخازن/استخرها در اسرع وقت بازیابی شود.
تعداد دفعات پایش پارامترهای محیطی عمدتاً به خودِ پارامتر(برحسب کارکرد فنی، زمان و هزینه اندازهگیری تعیین میشود؛ جدول 11.5 را ببینید) و همچنین سیستم تولید که پارامتر در آن اندازهگیری شدهاست، ارتباط آن در محیط تولید و مرحله عمر حیوانات ذخیره شده بستگی دارد. در سیستمهای گسترده و نیمه متراکم، ثبت بسیاری از پارامترهای کلیدی حداقل دو بار در روز توصیه میشود، بخصوص در اوایل صبح و اواخر بعد از ظهر، تا بزرگی کامل تغییرات روزانه مرتبط با دورههای روشن/تاریک درک شود. در ضمن، سیستمهای متراکم و فوق متراکم نیازمند یک برنامه پیش پیوستهتر به دلیل بارهای تولید بالا برحسب زیست توده در هر واحد مساحت و سرعتی هستند که در آن، پارامترها میتوانند به سمت سطوح زیربهینه افت کنند.
جدول 11.5. فراوانی پایش توصیه شده برای پارامترها براساس ویژگیهای سیستم تولید.
| پارامتر | گسترده | نیمه متراکم | متراکم | متراکم داخلی | فوق متراکم داخلی |
| فیزیکی | |||||
| دما | بالا | بالا | بالا | بسیار بالا | بسیار بالا |
| اکسیژن محلول | بالا | بالا | بالا | بسیار بالا | بسیار بالا |
| شوری | پایین | پایین | متوسط | متوسط | متوسط |
| مرتبط با کلسیفیکاسیون | |||||
| کربن دی اکسید | نامرتبط | نامرتبط | بالا | بسیار بالا | بسیار بالا |
| pH | پایین | بالا | بالا | بالا | بسیار بالا |
| قلیائیت | پایین | پایین | متوسط | متوسط | متوسط |
| کلسیم | پایین | پایین | متوسط | متوسط | متوسط |
| منیزیم | پایین | پایین | متوسط | متوسط | متوسط |
| محصولات غذایی دفعی | |||||
| آمونیاک | پایین | پایین | متوسط | متوسط | بالا |
| نیتریت | پایین | پایین | متوسط | متوسط | بالا |
| نیترات | پایین | پایین | متوسط | متوسط | متوسط |
اگرچه در بسیاری از موارد، اندازهگیریها بصورت دستی با استفاده از تجهیزات تخصصی کیتهای تست خیس انجام میشوند، بسیاری از پروبها و حسگرها نیز وجود دارند که قادر به ترجمه اندازهگیری یک پارامتر فیزیکی شیمیایی مورد نظر و تبدیل آن به یک سیگنال الکتریکی هستند که میتوان بعدها آن را گزارش داد، ثبت کرد یا در برخی موارد، بصورت خودکار بعنوان بخشی از یک سیستم کنترل براساس آن عمل کرد(مانند سیستمهای پرورش هوشمند، بخش مدیریت کیفیت آب را ببینید). این پروبها و حسگرها میتوانند با سیم یا بی سیم باشند و درون این شبکه کنترل ادغام شده یا بصورت مجزا مورد استفاده قرار بگیرند. چنین فناوری میتواند بسیاری از پارامترهای کلیدی کیفیت آب در زمان واقعی را برای توانمندسازی اقدام سریع جبرانی اندازهگیری کند. بنابراین، این بخش تکنیکهای دستی و خودکار(پروب/حسگر) برای پایش شیمی آب را معرفی میکند؛ ملاحظات لازم برای اندازهگیری آنها، که وابسته به تکنیک مورد استفاده هستند را ارائه میدهد؛ و بر پارامترهای فعلی تاکید دارد که برای آنها تکنیکها یا تجهیزاتی در دسترس نیستند یا هنوز برای اندازهگیری مقرون به صرفه، ایدهآل و مطمئن در یک موقعیت تجاری ایدهآل نیستند.
دما
در استخرهای تولید میگو، اندازهگیری دمای آب حداقل بصورت روزانه در جایی که پایش از تجهیزات دستی استفاده میکند مهم است، هرچند دوبار در روز توصیه میشود. در حالی که در بیشتر محیطهای تولید، امکان دستکاری دمای محیط در زمان انحراف از دامنه بهینه وجود ندارد، اما پایش مستمر امکان تنظیم نسبت غذا، کاهش یا افزایش میزان غذای داده شده به یک زیست توده مشخص از میگوها بسته به دمای آب وجود دارد. در حالی که اندازهگیری دستی دما، امکان درک تقریبی تغییرپذیری زمانی را فراهم میسازد، اما قابلیت حسگر برای پایش مستمر دما مطمئن و موثر است و بنابراین معرف گزینهی خوبی برای دستیابی به دادههای دمایی زمانی حتی برای مزارع روستایی، است.
پرکاربردترین حسگر مورد استفاده برای پایش آب، RTD(آشکارساز دمای مقاومت) است. دلیل اینکه اینها پرکاربردترین هستند دامنه کاری وسیع، دقت و مقرون به صرفه بودن آنهاست. حسگرهای دما ضدآب هستند تا انجام عملیات را حتی در حالت کاملاً زیرآب فراهم سازند و قادر به کار در دامنههای دمایی 5- تا 110 درجه سانتیگراد و فشارهای بیشتر به 10 بار هستند.
جانمائی آنها در استخر/مخزن باید تعویض آب مستمر در عنصر حسگر را فراهم سازد و بنابراین باید افت سطوح آب بیش از 75 درصد حجم کل را بدون غوطهور شدن توجیه کند(در مواجهه با هوا). این امر منجر به احتمال بالای جانمائی پروب در نواحی عمیقتر مخزن/استخر میشود. با این وجود، احتمال طبقهبندی دمایی معنادار و تغییرپذیری فضائی در دما در سطح استخرها باید در زمان پایش و جبران متعاقب انحرافات دمائی توجیه شود. فعالیتهای نگهداری پیشگیرانه باید شامل بازرسیهای هفتگی برای پاکسازی حسگر و چک آپهای ماهانه برای هر نوع آسیب بالقوه باشند.
شوری
بیشترین اندازهگیری دستی برای مولفه شوری با استفاده از یک شکستسنج انجام میشود، هرچند اندازهگیری مستمر رسانائی(تناسب مستقیم با شوری) به لحاظ فنی برای تولید تجاری آسان، مطمئن و نسبتاً ارزان است. همانند دما، جایی که پایش دستی است، فراوانی بیشتری از اندازهگیری امکان کنترل دقیقتر شوری را میسر میسازد. توصیه میشود که شوری حداقل دو بار در هفته اندازهگیری شود و فراوانی توصیه شده بصورت فصلی بسته به تاثیر معنادار تبخیر یا بارش باران در نواحی گرمسیری و نیمه گرمسیری در طی فصل بارانی افزایش یابد. پایش مکرر، کاهش سطوح شوری مضر از طریق رویههای مدیریت مزرعه که شامل افزودنی دستی نمکها به آب تولید در طی رویدادهای شیرینسازی(بارش باران) یا افزودن آب شیرین برای جبران سطوح بالای شوری(تبخیر) را تسهیل میبخشد.
برای اندازهگیری پیوسته، حسگرهای رسانائی توصیه شده، القائی هستند(بدون الکترود) با توجه به اینکه الزام اصلی، اجتناب از تماس بین عنصر حسگر(سیمپیچهای الکترود) و آب است. بیشتر حسگرها شامل دو سیمپیچ مسی هستند؛ یکی که تغییر میدان مغناطیسی را بسته به رسانائی آب تولید میکند و دومی که یک ولتاژ الکتریکی درون یک جسم PVC-C یا PTFE(تفلون) محافظ در مقابل اثرات زیانآور را القا میکند.
پروبهای رسانائی باید مقیاس رسانائی وسیعی داشتهباشند(مثلاً صفر تا 100 میلی زیمنس بر سانتیمتر) و به یک حسگر دمائی نوع RTD متصل باشند. جانمائی آنها در استخرها/مخازن باید در نواحی دارای اختلاط مناسب، نزدیک هرگونه جریان، باشد تا اطلاعات دقیق و مطمئن برای کنترل این پارامتر به دست آید. فعالیتهای نگهداری پیشگیرانه شامل بازرسیهای ماهانه برای پاکسازی حسگر و بازرسیها برای هر نوع آسیب بالقوه است. زمانی که رسانائی آب مشخص است، این مقدار را میتوان با استفاده از محاسبه ساده به شوری تبدیل کرد:
شوری(psu) = 0/4665 × رسانائی به توان 1/0878
که در آن واحدهای رسانائی برحسب زیمنس بر سانتیمتر و واحدهای شوری بر حسب ppt یا psu هستند. بیشتر پروبهای رسانائی مدرن به یک سیستم سنجش متصل میشوند که به طور خودکار خروجی اندازهگیری را به شوری تبدیل میکند.
اکسیژن محلول
به واسطه کنترل توسط فرایندهای بیولوژیکی در مخزن/استخر، همواره توصیه میشود که DO حداقل دوبار در روز و بلافاصله پس از تغذیه، در سیستمهای دستی، پایش شود. نصب پروبهای پایش منظم برای کنترل جدی این پارامتر محیطی به همراه آلارمهای متصل به این پروبهای برای آگاه ساختن پرورشدهندگان از انحرافات فراتر از دامنههای عملیاتی بهینه و نشان دادن مشکلات بالقوه در جهت اتخاذ اقدامات اصلاحی ایدهآل خواهد بود. در حالی که پروبهای ثابت DO به طرز معناداری گرانتر از پروبهای دمایی هستند، مقدار پایش پیوسته که رزولوشن مقیاس زمانی را میسر میسازد، بسیار مفید است. این امر به طور خاص به دلیل شدت اثرات بیولوژیکی DO پایین، ماهیت پویا و کاملاٌ متغیر DO در استخرهای میگو، بخصوص با تغییر در طی روز و شب و همچنین امکانسنجی فنی برای اتخاذ اقدام اصلاحی در جهت بازیابی سطوح بهینه DO و به دنبال آن اجتناب از پیامدهای مضر برای سلامتی، رخ میدهد.
پروبهای نوری که از فناوری فلورسنس استفاده میکنند، گزینه خوبی برای پایش DO فراهم میآورند، زیرا آنها یک طول عمر نسبتاً طولانی(2 تا 3 سال؛ پروبهای گالوانیکی یک طول عمر عملیاتی بیشتر را فراهم میسازند اما به طرز معناداری نیازمند نهداری بیشتر هستند)، پایداری و دقت را ایجاد میکنند. در بین سایر مزایا، این پروبها نیازمند جایگزینی و نگهداری محلولهای الکترولیت یا غشاها بعنوان بخشی از نگهداری منظم خود نیستند که برای پروبهای DO گالوانیک سنتی مورد نیاز هستند.
صرفنظر از فناوری مورد استفاده، پروبهای اکسیژن برای استفاده در آبزیپروری باید از حساسیت خوبی در سطوح پایین DO برخوردار باشند که دامنهای از 0/00 تا 300 درصد را بصورت اشباع هوا و 0/00 و 20/00 میلیگرم بر لیتر بعنوان محتوای اکسیژن با نازلهای خودتمیزکننده و جبران دمای خودکار پوشش میدهد.
این پروبها معمولاً دارای رتبه IP68 هستند که غوطهوری را امکانپذیر ساخته، تحت دامنههای دمایی 5- تا 50 درجه سانتیگراد کار کرده و فشارهای بیش از 10 بار را تحمل میکنند که آنها را برای بهرهبرداری تجاری مناسب میسازد.
جانمائی پروبهای DO درون مخزن/استخر باید نزدیک کف یا در نقاطی باشد که خوانش اکسیژن محلول کم امکانپذیر باشد(مثلاً نزدیک به جایی که غذا بصورت خودکار(فیدرهای خودکار) یا دستی(سمت مخزن/استخر انتخابی برای پخش غذا) توزیع میشود).
فعالیتهای نگهداری پیشگیرانه باید شامل بازرسی هفتگی تمیزسازی حسگر در مدلهای فاقد گزینه خودتمیزکنندگی و ماهانه برای هر آسیب بالقوه باشند.
pH
pH باید حداقل یک بار در روز با تعداد اندازهگیری متغیر بسته به شدت تولید و افزایش با زیست توده اندازهگیری شود. اندازهگیری pH توسط پروبها بصورت دستی یا پیوسته انجام میشود؛ با این وجود، ضروری است که پروبها همواره کالیبره و تمیز شوند(روزانه) تا خوانشهای دقیق، مطمئن و مناسب حاصل شود، بخصوص جایی که پروبهای ثابت به کار برده میشوند. بیشتر پروبهای pH درون بدنه شیشهای یا پلاستیکی با غشای حساس به pH در انتهای پروب ساخته شده از شیشه در ترکیب با الکترود مرجع و الکترولیت مرجع قرار دارند. این امر آنها را نسبتاً ظریف ساخته و در صورت حمل نادرست، در معرض خطر شکستگی قرار میدهد. با این وجود، حسگرهای جدید ISFET pH بیش از گذشته برای استفاده تجاری در دسترس هستند که فاقد مولفههای شیشهای شکننده هستند و بنابراین بسیار قدرتمندتر بوده و از دقت خوبی برخوردارند. با این وجود، آنها بسیار گرانتر هستند و لذا احتمالاً بصورت گسترده در پرورش میگو به کار نمیروند، تا زمانی که مقرون به صرفهتر شوند. صرفنظر از فناوری، الکترودهای pH معمولاً دامنههای اندازهگیری 0/0 تا 14/0 واحد pH را نشان میدهند و اغلب با حسگرهای دمای نوع RTD به دلیل وابستگی دمایی اندازهگیریهای pH ارائه میشوند.
الکترودهای pH در استخرها/مخازن باید در نواحی دارای اختلاط مناسب قرار بگیرند تا اطلاعات صحیح درخصوص پارامترها برای کنترل فراهم شود. فعالیتهای نگهداری پیشگیرانه شامل بازرسیهای حداقل هفتگی برای کالیبراسیونها، تمایزسازی حسگر و بازرسیها برای هر نوع آسیب بالقوه هستند. تعویض سالانه حسگر نیز توصیه میشود.
قلیائیت
پیشنهاد میشود که قلیائیت بایستی حداقل دو بار در هفته در استخرهای بیرونی اندازهگیری شود. علاوه بر این، اندازهگیری قلیائیت باید به دنبال هرگونه اقدام اصلاحی به منظور احیای pH بهینه با استفاده از افزودن ترکیبات قلیائی انجام شود. این امر تضمین خواهد کرد که دوز با موفقیت، اعمال شدهاست. در سیستمهایی که اکسیداسیون آمونیاک و نیتریت توسط باکتریها انجام میشود(AOB و NOB)، دفعات افزودن ماده قلیائی باید بسته به ماهیت میکروبهایی که از قلیائیت در طی این فرایند استفاده میکنند، افزایش یابند. این امر به طور خاص در طی هفتههای اول استقرار پرورش باکتریایی برای کنترل افزودن قلیائیت و حصول اطمینان از سطوح مناسب قلیائیت برای باکتریها مهم است.
قلیائیت بصورت گسترده با استفاده از کیتهای رنگسنجی دستی مانند آزمایشات قطره مایع، یا طیفسنج نوری، اندازهگیری میشود که دقت بیشتر و حدود تشخیص بالاتر را برای کنترل آن فراهم میآورند. دقت بسیار بیشتر را میتوان با استفاده از تکنیکهای تیتراسیون به دست آورد؛ هرچند، این رویکرد نیازمند یک سطح مهارت بالاتر توسط اپراتور و همچنین تجهیزات تخصصی است، به این معنا که اندازهگیری تیتراسیون قلیائیت به ندرت در یک وضعیت تجاری رخ میدهد. هیچ حسگر تجاری در حال حاضر برای سنجش قلیائیت وجود ندارد.
CO2
اندازهگیری CO2 در آبزیپروری چندان مورد توجه قرار نگرفتهاست، و به طور خاص در سیستمهای بیرونی نادیده گرفته شدهاست، در حالی که تلاشهایی به طور منظم برای کمیسازی این پارامتر در سیستمهای متراکم و فوق متراکم انجام شدهاست. همانگونه که پیش از این بحث شد، اندازهگیری مستقیم CO2 محلول به لحاظ فنی چالشبرانگیز است و تجهیزات لازم برای انجام این اندازهگیری در بخش اعظم محیطهای تولید تجاری گران هستند. تقریبهای غیرمستقیم غلظت CO2 محلول را میتوان از طریق استفاده از کیتهای آزمایش رنگسنجی به دست آورد که در آنها، کربن دی اکسید(بصورت کربنیک اسید) با یک محلول سدیم هیدروکسید رقیق تا pH 8/3 تیتر میشود(یا با استفاده از فنول فتالئین بعنوان یک شاخص تغییر رنگ برای رسیدن به pH) 8/3). با این وجود، چنین کیتهای آزمایشی دارای حساسیت کمی با توجه به الزامات CO2 محلول در دامنههای عملیاتی بهینه برای میگوها هستند. در ضمن، عدم درک رابطه شیمیایی پیچیده در آب با شیمی کربنات(قلیائیت) وجود دارد، لذا در حال حاضر، قابلیت اندازهگیری این روش رنگسنجی در زمینهی مدیریت موثر مزرعه نامناسب است. همانند pH و DO، اگر تجهیزات موثر اندازهگیری برای یک اندازهگیری مطمئن، دقیق و قدرتمند از CO2 محلول فراهم باشند، آنگاه CO2 محلول را باید به طور ایدهآل حداقل دوبار در روز اندازهگیری کرد، و دفعات اندازهگیری نیز با افزایش شدت تولید بالا میرود تا اقدامات اصلاحی برای تعیین مجدد مقادیر بهینه صورت پذیرد.
با این وجود، برخی ابزار برای اندازهگیری مستقیم CO2 محلول توسعه یافته و در محیطهای آبزیپروری مورد استفاده قرار گرفتهاند. این ابزار عموماً پروبهایی هستند که به غشای نفوذپذیر CO2 متکی هستند که اجازه میدهد CO2 در یک فضای پر از گاز درون پروب/ابزار پخش شود(گاهی اوقات واحد فضای هد یا HSU خوانده میشود) که درون آب قرار میگیرد تا اندازهگیری انجام شود. CO2 در این فاز گازی با فناوری مشابه استاندارد صنعتی مورد استفاده برای اندازهگیری سطوح CO2 جو اندازهگیری میشود، یعنی آنالیزور گاز مادون قرمز غیرپاشنده[10] که به نور جاذب CO2 در یک طول موج خاص(4/2 میکرومتر) متکی است. چنین حسگرهایی در پروژههای تحقیقاتی آبزیپروری(مانند پی فرر و همکاران، 2011) آزمایش شدهاند و در برخی از محیطهای آبزیپروری با فناوری بالاتر به کار رفتهاند. با این وجود، آنها گران قیمت هستند و هنوز به طور کامل مطمئن و قدرتمند فرض نمیشوند، بخصوص در سطوح CO2 آبزی کمتر که به تعادل جوی نرمال نزدیک میشوند. گزینههای دقیقتر دیگری براساس همین اصول(مانند، متعادلساز قابل حمل CO2 با NDIR؛ واتسون و همکاران، 2017) پیشنهاد شدهاند، اما هنوز به لحاظ تجاری در دسترس نیستند و هزینهی تقریبی 4 هزار دلار برای تولید سفارشی دربردارند. فناوری حسگر مقرون به صرفهتر اما کماکان دقیق ممکن است گزینههای بهتری برای دامنه وسیعتری از محیطهای آبزیپروری در آینده فراهم سازد؛ برای مثال، براساس به کارگیری یک غشای شیمیایی حسگر CO2 مستقیم(مدنز و همکاران، 2019).
در صورت استفاده و همانند پروبهای DO، توصیه میشود که حسگرهای CO2 در ناحیهای قرار بگیرند که امکان تعویض آب مستمر فراهم شود و در مناطقی نصب شوند که شرایط افزایش CO2 وجود داشتهباشد، یا در مجاورت کف استخر یا جایی که غذا در استخر توزیع میشود(بصورت خودکار یا دستی). نگهداری پیشگیرانه باید شامل تمیزسازی هفتگی حسگر، بازرسیها برای هر آسیب بالقوه، کالیبراسیونها و تعویض سالانه باشد.
سختی
سختی بیانگر غلظت ترکیبی یونهای کلسیم و منیزیم، یعنی کاتیون دوظرفیتی عمده در آبهای طبیعی است. غلظت این دو یون در آب شیرین بسیار متغیر، اما آب دریا دارای نسبتهای نسبتاً ثابتی از این دو یون است(Mg2+ در 52 mM به طرز زیادی فراتر از Ca2+ در 10 mM در آب دریای توان کامل است، شوری = 35 psu). همانند قلیائیت، سختی اغلب برحسب میلیگرم بر لیتر بصورت کلسیم کربنات(میلیگرم بر لیتر CaCO3) گزارش میشود که فرض میکند تمامی کاتیونهای دوظرفیتی کلسیم هستند و همگی از انحلال کلسیم کربنات جامد به دست آمدهاند. با این وجود، سختی گاهی اوقات بصورت درجاتی از سختی کلی اندازهگیری میشود(dGH یا oGH؛ که در آن 1 dGH = 17/9 میلیگرم بر CaCO3 است). اگرچه سختی کمیت کل کلسیم و منیزیم محلول را مشخص میکند، اما مشخص نمیکند که آیا سختی عمدتاً شامل کلسیم یا منیزیم یا ترکیبی این دو است. این فقدان کمیسازی خاص یون(های) دوظرفیتی یک مسئله مهم در پرورش میگو است، چون این کلسیم است که برای کلسیفیکاسیون پس از پوستاندازی مورد نیاز است نه منیزیم.
سختی را میتوان با استفاده از یک روش تیتراسیون براساس افزودن محلول استاندارد EDTA اندازهگیری کرد، که یونهای Ca2+ و Mg2+ را کمپلکس میکند. زمانی که این یونها همگی کمپلکس شدند، افزودن بیشتر EDTA منجر به تغییر رنگ در زمان وجود شاخص میشود(مانند اریوکروم بلک تی) و کمیت EDTA مورد استفاده به سختی تبدیل میشود. برای اطلاعات خاصتر درخصوص کلسیم، نمونههای آب را میتوان(به ترتیب نزولی دقت) با استفاده از کیتهای آزمایش شیمی خیس، فوتومتری شعله[11]، طیفسنجی نوری جذب اتمی[12] یا سیستمهای کروماتوگرافی یون[13] آنالیز کرد. اگرچه FP با افزایش دقت همراه است، اما پرهزینه است(هزاران دلار) و AAS و ICS بسیار گران هستند(دهها هزار دلار) و نیازمند تاسیسات آزمایشگاهی پیشرفته و تجربه تحلیلی فراوان هستند. الکترودهای انتخابی یون[14] برای اندازهگیری یونهای کلسیم وجود دارند، اما اینها نیز گران قیمت هستند(هزاران دلار)، در آب شیرین نسبت به آب شور بسیار مطمئنتر هستند و طبق اطلاعات ما، تنها در محیطهای پژوهش تا به امروز و نه در آبزیپروری مورد استفاده قرار گرفتهاند.
متغیرهای نیتروژن پسماند
هنوز یک فناوری پایش مستمر و مطمئن برای سنجش دقیق محصولات نیتروژن در آب دریا شامل NH3، NO2– و NO3– در سطوح کاربرد تجاری وجود ندارد، حتی زمانی که علاقهمندی زیادی در جامعه علمی و صنعت آبزی برای توسعه این نوع فناوری وجود دارد. برای مثال، اندازهگیری مستمر و در محل آمونیاک، که در عملیات متراکم میگو ضروری به نظر میرسد، و بخصوص در کاربردهای RAS، یک چالش برای محققان باقی میماند. فناوری توسعه یافته مبتنی بر استفاده از الکترودهای انتخابی یون[15] برای تعیین یونهای آمونیوم به جای خودِ گاز آمونیاک است و زمانی که قدرت یونی(شوری) بالاست، چالش بیشتری ایجاد میکند.
دینگ و همکاران(2017) به کاربرد حسگرهای پتانسیومتری برای تشخیص نیتروژن آمونیاک در محل(TAN، آمونیاک و یون آمونیوم) در محیطهای آب دریا پرداختند. یک طراحی پیشنهاد شد که الکترود انتخابی آمونیاک غشای پلیمری را با یک لایه بافر هیدروژل با pH 7/0 و یک غشای نفوذپذیر گاز ترکیب میکرد. شکل گازی آمونیاک NH3 در آب دریا در غشای گاز پخش میشود و به آمونیوم NH4+ در بافر هیدروژل تبدیل میشود. این امر امکان سنجش پتانسیومتری آمونیوم را فراهم ساخته و حساسیت تشخیص TAN توسط تاثیر تله بافر را بهبود میدهد.
پرورش هوشمند
فناوری سنجش، کنترل و مدیریت از راه دور پارامترهای کیفیت آب در محل مورد توجه قرار گرفتهاست و مدیریت مزرعه را برای کمک به کاهش خطرات تولید، بهبود برنامهریزی تولید و افزایش بهرهوری(و سوددهی) تسهیل بخشیدهاست. فناوری مورد استفاده برای دستیابی به این پایش با هدف کاهش خطاها در اندازهگیری و کسب داده و بهینهسازی عملیات تجاری توسعه یافتهاست. علیرغم این پیشرفت تکنولوژیکی، یک عنصر انسانی برای مدیریت مزرعه باقی میماند که نیازمند آن است که اپراتورها یا تکنیسینهای مزرعه تجهیزات را در وضعیت اندازهگیری آماده، مطمئن و موثر حفظ کنند، دادههای حاصل را به درستی گردآوری و تفسیر نمایند، براساس این اطلاعات اقدام به موقع در جهت تسهیل کاهش موثر شرایط مضر محیطی اتخاذ نمایند. این امر اختلافی را بین تحلیل و مدیریت پرورش مزرعه ایجاد میکند، بخصوص در انتقال بین تکنیکهای تولید گسترده و متراکم. در نتیجه، پیشرفتها در فناوریهای اطلاعات و ارتباطات، به همراه توسعهی حسگرهای کم هزینه، امکان و مقرون به صرفه بودن پایش و کنترل پارامترهای متعدد محیطی را افزایش دادهاست و فرصتهای جدیدی را برای پلتفرمهای مدیریت هوشمند مزرعه خلق کردهاست(سو و همکاران، 2019) که در تمامی محیطهای تولید قابل استفاده هستند و به پر کردن شکاف تکنولوژیکی بین مدلهای تولید گسترده و فوق متراکم کمک میکنند(شکل 11.5 را ببینید). با این وجود، چالشهای عمدهای درخصوص پایش پارامتر محیطی در تمامی سطوح تولید میگو باقی میماند. لذا، پیشرفتهای بیشتر در توسعه تکنولوژیکی و کاربرد، بسیار کلیدی هستند و در میان موارد امروزی، آنگونه که در این فصل شرح داده شدهاست، درک، اندازهگیری و جبران شرایط محیطی مضر با توجه به کربن دی اکسید، قلیائیت و pH و همچنین کاتیونهای دوظرفیتی(کلسیم و منیزیم) قرار دارن.
- IOT؛ اینترنت اشیاء
- SDA؛ کسب دادههای نظارتی
- ACB؛ جعبه کنترل اتوماسیون
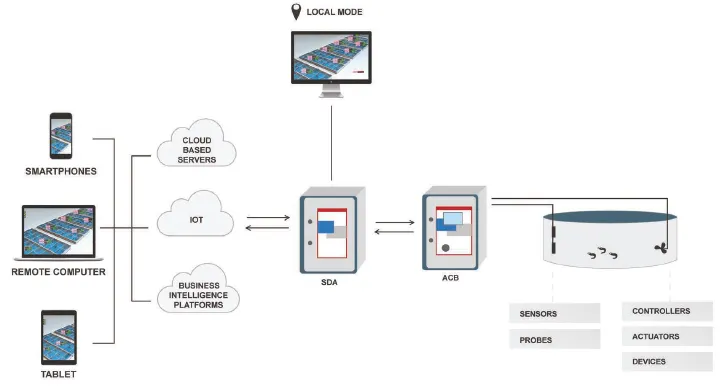 شکل 11.5. معماری معمولی پرورش هوشمند
شکل 11.5. معماری معمولی پرورش هوشمند
نتیجهگیری و مسیرهای آینده
همانگونه که شدت تولید در سطح جهانی افزایش یافتهاست، و از فرصت اقتصادی عظیمی که این بخش خلق کردهاست بهرهبرداری صورت گرفتهاست، اهمیت حفظ پارامترهای محیط در یک دامنه بهینه غیرقابل تردید است. در راستای توسعهی این بخش، حجم رو به رشدی از مطالعات انجام شدهاست که به چالشهای کلیدی تولید میپردازند. نشان داده شدهاست که صرفنظر از سیستم تولید مورد استفاده، شرایط محیطی، فیزیولوژی میگو، پاسخ ایمنی(و به دنبال آن حساسیت به بیماری) و پوستاندازی، را از طریق کلسیفیکاسیون پس از پوستاندازی و نرخ رشد دیکته میکنند و برای موفقیت تولید نیز ضروری هستند. علاوه بر این، دامنه بهینه برای هر پارامتر برحسب مرحله چرخه عمر میگوها و همچنین شاخص عملکرد اندازهگیری شده تعیین میشود. دما شاید پارامتری باشید که بیشترین مطالعات در حوزه بیولوژی میگو به آن اختصاص دارد و به لحاظ سنتی، عامل فراگیری است که تعیین میکند تولید میگو در بعد جهانی در کجا امکانپذیر است. حساسیت به دماهای سردتر در طی مراحل اولیه چرخه عمر بصورت گسترده اثبات شدهاست و ناتوانی در دستکاری دما در سطح مزرعه کاملا مانع از حفاظت در خارج از نواحی گرمسیری و نیمه گرمسیری شدهاست. با این وجود، یک حرکت به سمت تولید در محیط داخل از سال 2005 فرصتی را برای کنترل بیشتر دما در دامنه وسیعی از اقلیمها و مسیری را فراهم ساختهاست که با آن پرورش میگو در سرتاسر جهان گسترش مییابد. همانند دما، شوری و اکسیژن نیز به خوبی از نقطه نظر سلامت میگو بررسی شدهاند و به خوبی در زمینه پرورش درک شدهاند. این امر با قابلیت دسترسی نسبی و مقرون به صرفه بودن فناوری پایش برای این پارامترها از بعد تجاری تسهیل یافتهاست و منجر به پروتکلهایی برای حفظ این پارامترها در دامنههای بهینه خاص زمینه(مانند مرحله چرخه عمر) یا سهولت دستکاری شوری و DO در زمان زیربهینه بودن شرایط شدهاست. بالعکس، پارامترهای شیمی کربنات مانند CO2 محلول، قلیائیت و pH، و همچنین کلسیم و منیزیم(ارتباط مستقیم با کلسیفیکاسیون)، حداقل با توجه به بیولوژی میگو و پرورش آن مورد مطالعه و بررسی قرار گرفتهاند. این متغیرها شاید در زمان پرداختن به شکاف در درک کنونی، بیشترین فرصت را برای بهینهسازی محیطهای تولید خلق میکنند. همانگونه که در کل این فصل مطرح شد، سوالات زیر بیانگر شکافهای کلیدی دانش هستند که برای بررسی بیشتر موضوعی و به موقع هستند:
- دامنههای بهینه برای کلسیفیکاسیون پس از پوستاندازی برحسب شیمی کربنات(CO2، قلیائیت، pH) و کاتیونهای دوظرفیتی(کلسیم و منیزیم) کدامند؟
- این دامنههای بهینه چگونه با مرحله عمر تغییر میکنند؟
- گزینههای موجود برای توسعه حسگرهای دقیق و مقرون به صرفه برای CO2، قلیائیت، کلسیم و منیزیمی که میتوان در تمامی محیطهای آبزیپروری میگو به کار گرفت کدامند؟
جدول 11.6. واژهنامه اختصارات
| اختصار | معنا |
| LC50 | غلظت موادی که باعث مرگ و میر 50 درصد میشوند |
| EC50 | غلظت موادی که باید تاثیر معناداری در 50 درصد نمونههای شما میشوند |
| WSSV | ویروس سندروم لکه سفید |
| TAN | کل نیتروژن آمونیاک: آمونیوم و آمونیاک غیریونیزه |
| LOEC | کمترین غلظت تاثیر مشاهده شده |
جدول 11.7. واژهنامه اسامی خاص
| نام علمی | نام رایج |
| پنائوس زاپونیکاس | کورما پرون |
| پنائوس مونودون | میگوی ببری سیاه |
| پنائوس استیلیروستریس | میگوی آبی غربی |
| لیتوپنائوس اسچمیت | میگوی سفید شرقی |
| پورتون پیلاگیتوس | میگوی شناگر آبی |
| پنائوس پائولنسیس | میگوی سائو پائولو |
| پنائوس وانامی | میگوی سفید |
منابع و مراجع
Allan, G.L. and Maguire, G.B. (1991) Lethal levels of low dissolved oxygen and efects of short-term oxygen stress on subsequent growth of juvenile Penaeus monodon. Aquaculture 94, 27e37.
Armstrong, D.A., Chippendale, D., Knight, A.W. and Colt, J.E. (1978). Interaction of ionized and un-ionized ammonia on short-term survival and growth of prawn larvae, Macrobrachium rosenbergii. Te Biological Bulletin 154, 15–31.
Arnold, K.E., Findlay, H.S., Spicer, J.I., Daniels, C.L. and Boothroyd. D. (2009). Efect of CO2-related acidifcation on aspects of the larval development of the European lobster, Homarus gammarus (L.). Biogeosciences 6(8), 1747– 1754.
Barbieri, E. (2010) Acute toxicity of ammonia in white shrimp (Litopenaeus schmitti) (Burkenroad, 1936, Crustacea) at diferent salinity levels. Aquaculture 306, 329–333.
Barbieri, R.C.J. and Ostrensky, A. (2002). Camarões Marinhos. Engorda, Viçosa, Brazil, 370 pp
Bett, C. and Vinatea, L. (2009). Combined efect of body weight, temperature and salinity on shrimp Litopenaeus vannamei oxygen consumption rate. Brazilian Journal of Oceanography 57, 305–314.
Boltana, S., Aguilar, A., Sanhueza, N., Donoso, A., Mercado, L., Imarai, M. and Mackenzie, S. (2018). Behavioural fever drives epigenetic modulation of the immune response in fsh. Frontiers in Immunology 9, 1241.
Boyd, C.E. (1989). Water Quality Management and Aeration in Shrimp Farming. Auburn University Press, Alabama, USA.
Boyd, C.E. (1990). Water Quality in Ponds for Aquaculture. Auburn University Press, Alabama, USA.
Boyd, C.E. and Gross, A. (2004). Water use and conservation for inland aquaculture ponds. Fisheries Management and Ecology 7(1–2), 55–63.
Boyd, C.E. and McNevin, A.A. (2018). Land use in shrimp aquaculture. World Aquaculture 49(1), 28–34.
Boyd, C.E., McNevin, A.A., Davis, R.P., Godumala, R. and Mohan, A.B.C. (2018). Production methods and resource use at Litopenaeus vannamei and Penaeus monodon farms in India compared with previous fndings from Tailand and Vietnam. Journal of the World Aquaculture Society 49(3), 551–569.
Boyd, C.E. and Tucker, C.S. (1992). Water Quality and Pond Analyses for Aquaculture. Agricultural Experiment Station, Alabama, USA.
Brauner, C.J., Shartau, R.B., Damsgaard, C., Esbaugh, A.J., Wilson, R.W. and Grosell, M. (2019). Acid–base physiology and CO2 homeostasis: Regulation and compensation in response to elevated environmental CO2. Fish Physiology 37, 69–132.
Bray, W.A., Lawrence, A.L. and Leung-Trujillo, J.R. (1994). Te efect of salinity on growth and survival of Penaeus vannamei, with observations on the interaction of IHHN virus and salinity. Aquaculture 122, 133–146.
Burford, M.A., Tompson, P.J., McIntosh, R.P., Bauman, R.H. and Pearson, D.C. (2003). Nutrient and microbial dynamics in high-intensity, zero-exchange shrimp ponds in Belize. Aquaculture 219, 393–411.
Burford, M.A. and Williams, K.C. (2001). Te fate of nitrogenous waste from shrimp feeding. Aquaculture 198, 79–93.
Burgents, J.E., Burnett, K.G. and Burnett, L.E. (2005). Efects of hypoxia and hypercapnic hypoxia on the localization and the elimination of Vibrio campbellii in Litopenaeus vannamei, the Pacifc white shrimp. Te Biological Bulletin 208, 159–168.
Cai, Y., Chen, T., Ren, C., Huang, W., Jiang, G., Huo, D. and Hu, C. (2017). Molecular charcaterization of Pacifc white shrimp (Litopenaeus vannamei) sodium bicarbonate cotransporter (NBC) and its role in response to pH stress. Fish and Shellfsh Immunology 64, 226–233.
Cameron, J.N. and Wood, C.M. (1985). Apparent H+ excretion and CO2 dynamics accompanying carapace mineralization in the blue crab (Callinectes sapidus) following moulting. Journal of Experimental Biology 114(1), 181–196.
Castille, F.L. and Lawrence, A.L. (1981). Te efect of salinity on the osmotic, sodium and chloride concentrations in the hemolymph of euryhaline shrimp of the genus Penaeus. Comparative Biochemistry and Physiology A 68, 75–80.
Cavalli, R O., Peixoto, S.M. and Wasielesky, W. (1998). Performance of Penaeus paulensis (Perez-Farfante) broodstock under long-term exposure to ammonia. Aquaculture Research 29, 815–822.
Ceballos-Vázquez, B.P., Palacios, E., Aguilar-Villavicencio, J. and Racotta, I.S. (2010). Gonadal development in male and female domesticated whiteleg shrimp, Litopenaeus vannamei, in relation to age and weight. Aquaculture 308, 116–123.
Ceballos-Vázquez, B.P., Rosas, C. and Racotta, I.S. (2003). Sperm quality in relation to age and weight of white shrimp Litopenaeus vannamei. Aquaculture 228, 141–151.
Chang, Z.W., Chiang, P.C., Cheng, W. and Chang, C.C. (2015). Impact of ammonia exposure on coagulation in white shrimp, Litopenaeus vannamei. Ecotoxicology and Environmental Safety 118, 98–102.
Chantal, M., Etienne, Z., Cyrille, G. and Hugues, L. (2008). Combined efect of exposure to ammonia and hypoxia on the blue shrimp Litopenaeus stylirostris survival and physiological response in relation to molt stage. Aquaculture 274, 398–407.
Charmantier, G., Soyez, C. and Aquacop, K. (1994). Efect of molt stage and hypoxia on osmoregulatory capacity in the peneid shrimp Penaeus vannamei. Journal of Experimental Marine Biology and Ecology 178, 233e46.
Chen, J.C. and Kou, Y.Z. (1992). Efects of ammonia on growth and molting of Penaeus japonicus juveniles. Aquaculture 104, 249–260
Chen, J.C. and Lin, C.Y. (1992). Efects of ammonia on growth and molting of Penaeus monodon juveniles. Comparative Biochemistry and Physiology C 101, 449–452.
Chen, T., Lin, T., Li, H., Lu, T., Li, J., Huang, W. et al. (2018). Heat shock protein 40 (HSP40) in Pacifc white shrimp (Litopenaeus vannamei): Molecular cloning, tissue distribution and ontogeny, ersponse to temperature, acidity/ alkalinity and salinity stresses, and potential role in ovarian development. Frontiers in Physiology 9, 1784.
Cheng, W., Liu, C.H., Hsu, J.P. and Chen, J.C. (2002). Efect of hypoxia on the immune response of giant freshwater prawn Macrobrachium rosenbergii and its susceptibility to pathogen Enterococcus. Fish and Shellfsh Immunology 13, 351e65.
Cheng, W., Liu, C.H. and Kuo, C.M. (2003). Efects of dissolved oxygen on hemolymph parameters of freshwater giant prawn Macrobrachium rosenbergii (de Man). Aquaculture 220, 843e56.
Cheng, W., Wang, L.U. and Chen, J.C. (2005). Efect of water temperature on the immune response of white shrimp Litopenaeus vannamei to Vibrio alginolyticus. Aquaculture 250, 592–601.
Chien, Y.H. (1992). Water quality requirements and management for marine shrimp culture. In Wyban, J. (ed.) Proceedings of the Special Session on Shrimp Farming, World Aquaculture Society, Baton Rouge, Louisiana, USA, 25 pp.
Chong-Robles, J., Charmantier, G., Boulo, V., Lizárraga-Valdéz, J., Enríquez-Paredes, L.M. and Gifard-Mena, I. (2014). Osmoregulation pattern and salinity tolerance of the white shrimp Litopenaeus vannamei (Boone, 1931) during post-embryonic development. Aquaculture 422, 261–267.
Clarke, A. and Johnston, N.M. (1999). Scaling of metabolic rate with body mass and temperature in teleost fsh. Journal of Animal Ecology 68(5), 893–905.
Colt, J.E. and Armstrong, D.A. (1981). Nitrogen Toxicity to Crustaceans, Fish, and Molluscs (eds Allen, J.L. and Kinney, E.C.). American Fisheries Society, Northeast Society of Conservation Engineers, Bethesda, Maryland USA. Datta, S. (2012). Management of Water Quality in Intensive Aquaculture. Available at https://www.researchgate.net/ publication/259175404_Management_of_Water_Quality_in_Intensive_Aquaculture (accessed 13 July 2021).
Davis, D.A., Saoud, I.P., McGraw, W.J. and Rouse, D.B. (2002). Considerations for Litopenaeus vannamei reared in inland low salinity waters. In: Cruz-Suárez, L.E., Ricque-Marie, D., Tapia-Salazar, M., Gaxiola-Cortés, M.G. and Simoes, N. (eds) Avances en Nutrición Acuícola VI. Memorias del VI Simposium Internacional de Nutrición Acuícola. 3 al 6 de Septiembre del 2002. Cancún, Quintana Roo, México.
De Lourdes Cobo, M., Sonnenholzner, S., Wille, M. and Sorgeloos, P. (2012). Ammonia tolerance of Litopenaeus vannamei (Boone) larvae. Aquaculture 45, 470–475.
Diaz, F., Farfan, C., Sierra, E. and Re, A.D. (2001). Efects of temperature and salinity fuctuation on the ammonium excretion and osmoregulation of juveniles of Penaeus vannamei, Boone. Marine and Freshwater Behaviour and Physiology 34, 93–104.
Ding, L., Ding, J., Ding, B. and Qin, W. (2017). Solid-contact potentiometric sensor for the determination of total ammonia nitrogen in seawater. International Electrochemical Science 12, 3296–3308.
Ding, S., Wang, F., Dong, S. and Li, J. (2014). Comparison of the respiratory metabolism of juvenile Litopenaeus vannamei culture in seawater and freshwater. Journal of the Ocean University of China 13, 331–337.
Duan, Y., Liu, Q., Wang, Y., Zhang, J. and Xiong, D. (2018). Impairment of the intestine barrier function in Litopenaeus vannamei exposed to ammonia and nitrite stress. Fish and Shellfsh Immunology 78, 279–288.
Ellis, R.P., Parry, H., Spicer, J.I., Hutchinson, T.H., Pipe, R.K. and Widdicombe, S. (2011). Immunological function in marine invertebrates: Responses to environmental perturbation. Fish and Shellfsh Immunology 30, 1209–1222.
Ellis, R.P., Urbina, M.A. and Wilson, R. (2017). Lessons from two high CO2 worlds – future oceans and intensive aquaculture. Global Change Biology 23(6), 2141–2148.
Escobedo-Bonilla, C.M., Wille, M., Alday Sanz, V., Sorgeloos, P., Pensaert, M.B. and Nauwynck, H.J. (2007). Pathogenesis of a Tai strain of white spot syndrome virus (WSSV) in juvenile, specifc pathogen-free Litopenaeus vannamei. Diseases of Aquatic Organisms 74, 85–94.
Eshchar, M. Lahav, O., Mozes, N., Peduel, A. and Ron, B. (2006). Intensive fsh culture at high ammonium and low pH. Aquaculture 255(1–4), 301–313.
Evans, S.S., Repasky, E.A. and Fisher, D.T. (2015). Fever and the thermal regulation of immunity: the immune system feels the heat. Nature Reviews in Immunology 15, 335–349.
FAO (2019). GLOBEFISH Highlights April 2019 Issue, with Jan.–Dec. 2018 Statistics – A quarterly update on world seafood markets. Globefsh Highlights no. 2-2019.
Fawen, H., Luqing, P. and Futao, J. (2009). Efects of hypoxia on dopamine concentration and the immune response of white shrimp (Litopenaeus vannamei). Journal of the Ocean University of China Oceanic Coastal and Sea Research 8, 77–82.
Feliu, V., Rivas, R. and Castillo, F. (2009) Fractional order controller robust to time delay variations for water distribution in an irrigation main canal pool. Computers and Electronics in Agriculture 69, 185–197.
Feng, C., Tian, X., Dong, S., Su, Y., Wang, F. and Ma, S. (2008). Efects of frequency and amplitude of salinity fuctuation on the growth and energy budget of juvenile Litopenaeus vannamei (Boone). Aquaculture Research 39, 1639–1646.
Ferreira, N.C., Bonetti, C. and Seifert, W.Q. (2011). Hydrological and water quality indices as management tools in marine shrimp culture. Aquaculture 318(3–4), 425–433.
Fouzi, M., Sharif, M., Omar, A.R., Yusof, F. and Tan, S.W. (2010). TaqMan real-time PCR assay for relative quantifcation of white spot syndrome virus infection in Penaeus monodon Fabricius exposed to ammonia. Journal of Fish Diseases 33, 931–938.
Freeman, J.A. (1990). Molt increment, molt cycle duration, and tissue growth in Palaemonetes pugio Holthuis larvae. Journal of Experimental Marine Biology and Ecology 143(1–2), 47–61.
Frías-Espericueta, M.G., Harfush-Melendez, M., Osuna-López, J.I. and Páez-Osuna, F. (1999). Acute toxicity of ammonia to juvenile shrimp Penaeus vannamei Boone. Bulletin of Environmental Contamination and Toxicology 62, 646–652.
Frias-Espericueta, M.G., Harfush-Melendez, M. and Páez-Osuna, F. (2000). Efects of ammonia on mortality and feeding of postlarvae shrimp Litopenaeus vannamei. Bulletin of Environmental Contamination and Toxicology 65, 98–103.
Furtado, P.S., Poersch, L.H. and Wasielesky Jr, W. (2011). Efect of calcium hydroxide, carbonate and sodium bicarbonate on water quality and zootechnical performance of shrimp Litopenaeus vannamei reared in bio-focs technology (BFT) systems. Aquaculture 321(1–2), 130–135.
Furtado, P.S., Campos, B.R., Serra, F.P., Klosterhof, M., Romano, L.A. and Wasielesky, W. (2014). Efects of nitrate toxicity in the Pacifc white shrimp, Litopenaeus vannamei, reared with biofoc technology (BFT). Aquaculture International 23, 315–327.
Furtado, P.S., Fugimura, M.M., Monserrat, J.M., Souza, D.M., Garcia, L.D.O. and Wasielesky, W. (2015a). Acute efects of extreme pH and its infuences on the survival and biochemical biomarkers of juvenile White Shrimp, Litopenaeus vannamei. Marine and Freshwater Behaviour and Physiology 48(6), 417–429.
Furtado, P.S., Poersch, L.H. and Wasielesky, W. (2015b). Te efect of diferent alkalinity levels on Litopenaeus vannamei reared with biofoc technology (BFT). Aquaculture International 23(1), 345–358.
Furtado, P.S., Valenzuela, M.A.J., Rodriguez-Fuentes, G., Campos, B.R., Wasielesky, W. and Gaxiola, G. (2016a). Chronic efect of nitrite on the rearing of the white shrimp Litopenaeus vannamei in two salinities. Marine and Freshwater Behaviour and Physiology 49, 201–211.
Furtado, P.S., Valenzuela, M.A., Badillo, M.A., Gaxiola, G., and Wasielesky Jr, W. (2016b). Efect of dissolved carbon dioxide on oxygen consumption in the Pacifc white shrimp, Litopenaeus vannamei (Boone 1931). Marine and Freshwater Behaviour and Physiology 49(5), 337–346.
Furtado, P.S., Gaona, C.A., Serra, F.P., Poersch, L.H. and Wasielesky Jr, W. (2017). Acute toxicity of carbon dioxide to juvenile marine shrimp Litopenaeus vannamei (Boone 1931). Marine and Freshwater Behaviour and Physiology 50(4), 293–301.
Gong, H., Jiang, D.H., Lightner, D.V, Collins, C. and Brock, D. (2004). A dietary modifcation approach to improve the osmoregulatory capacity of Litopenaeus vannamei cultured in the Arisona desert. Aquaculture Nutrition 10, 227–236.
González, R.A., Díaz, F., Licea, A., Denisse Re, A., Noemí Sánchez, L. and García-Esquivel, Z. (2010). Termal preference, tolerance and oxygen consumption of adult white shrimp Litopenaeus vannamei (Boone) exposed to diferent acclimation temperatures. Journal of Termal Biology 35, 218–224.
Granja, C., Vidal, O., Parra, G. and Salazar, M. (2006). Hyperthermia reduces viral load of white spot syndrome virus in Penaeus vannamei. Diseases of Aquatic Organisms 68, 175–180.
Han, S. Y., Wang B.J., Liu M., Wang M.Q., Jiang K.Y. and Liu, X.W. (2018). Adaptation of the white shrimp Litopenaeus vannamei to gradual changes to a low-pH environment. Ecotoxicology and Environmental Safety 149, 203–210.
Han, S., Wang, B., Wang, M., Liu, Q., Zhao, W. and Wang, L. (2017). Efects of ammonia and nitrite accumulation on the survival and growth performance of white shrimp Litopenaeus vannamei. Invertebrate Survival Journal 14, 221–232.
Hargreaves, J.A. and Tucker, C.S. (2012). Measuring dissolved oxygen concentration in aquaculture. SRAC Publication No. 4601.
Harlıoğlu, M.M., Farhadi, A. and Gür, S. (2018). Determination of sperm quality in decapod crustaceans. Aquaculture 490, 185–193.
Hartnoll, R.G. (2001). Growth in Crustacea – twenty years on. Hydrobiologia 449, 111–122.
He, P., Wei, P., Zhang, B., Zhao, Y., Li, Q., and Chen, X. (2018) Identifcation of microRNAs involved in cold adaptation of Litopenaeus vannamei by high-throughput sequencing. Gene 677, 24–31.
Hoppe, C.J.M., Langer, G., Rokitta, S.D., Wold-Gladrow, D.A. and Rost, B. (2012). Implications of observed inconsistencies in carbonate chemistry measurements for ocean acidifcation studies. Biogeosciences 9(7), 2401–2405.
Huang, W., Ren, C., Li, H., Huo, D., Wang, Y. and Jiang, X. (2017). Transcriptomic analyses on muscle tissues of Litopenaeus vannamei provide the frst profle insight into the response to low temperature stress. PLoS ONE 12, e178604.
Ip, Y.K. and Chew, S.F. (2010). Ammonia production, excretion, toxicity, and defense in fsh: a review. Frontiers in Physiology 1, 134.
Israngkura, A. and Sae-Hae, S. (2002). A review of economic impacts of aquatic animal disease. In: Arthur, J.R., Phillips, M.J., Subasinghe, R.P., Reantaso, M.B. and McCrae, I.H. (eds) Primary Aquatic Animal Health Care in Rural, Small-scale Aquaculture Development, Technical Proceedings of the Asia Regional Scoping Workshop. FAO Fisheries Technical Paper 406, FAO, Rome, pp. 55–61.
Jackson, C., Preston, N., Tompson, P.J. and Burford, M. (2003). Nitrogen budget and efuent nitrogen components at an intensive shrimp farm. Aquaculture 218, 397–411.
Jiang, D.H., Lawrence, A.L., Neill, W.H. and Gong, H. (2000). Efects of temperature and salinity on nitrogenous excretion by Litopenaeus vannamei juveniles. Journal of Experimental Marine Biology and Ecology 253, 193–209.
Jiang, L., Pan, L. and Fang-Bo., T. (2005). Efect of dissolved oxygen on immune parameters of the white shrimp Litopenaeus vannamei. Fish and Shellfsh Immunology 18(2), 185–188.
Kuhn, D.D., Smith, S.A., Boardman, G.D., Angier, M.W., Marsh, L. and Flick, G.J. (2010). Chronic toxicity of nitrate to Pacifc white shrimp, Litopenaeus vannamei: Impacts on survival, growth, antennae length, and pathology. Aquaculture 309, 109–114.
Kunkel, J.G. and Jercinovic, M.J. (2013). Carbonate apatite formulation in cuticle structure adds resistance to microbial attack for American lobster. Marine Biology Research 9(1), 27–34.
Laramore, S., Laramore, C.R. and Scarpa, J. (2001). Efect of low salinity on growth and survival of postlarvae and juvenile Litopenaeus vannamei. Journal of the World Aquaculture Society 32, 385–392.
Lemonnier, H., Bernad, E., Boglio, E., Goarant, C. and Cochard, J. (2004). Infuence of sediment characteristics on shrimp physiology: pH as principal efect. Aquaculture 240(1–4), 297–312.
Le Moullac, G., Soyez, C., Saulnier, D., Ansquer, D., Avarre, C.J. and Levy, P. (1998). Efect of hypoxic stress on the immune response and the resistance to vibriosis of the shrimp Penaeus stylirostris. Fish and Shellfsh Immunology 8, 621e9.
Li, C.C. and Chen, J.C. (2008). Te immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus under low and high pH stress. Fish and Shellfsh Immunology 25(6), 701–709.
Li, E., Chen, L., Zeng, C., Chen, X., Yu, N., Lai, Q. and Qin, J.G. (2007). Growth, body composition, respiration and ambient ammonia nitrogen tolerance of the juvenile white shrimp, Litopenaeus vannamei, at diferent salinities. Aquaculture 265, 385–390.
Li, E., Chen, L., Zeng, C., Yu, N., Xiong, Z. and Chen, X. (2008). Comparison of digestive and antioxidant enzymes activities, haemolymph oxyhemocyanin contents and hepatopancreas histology of white shrimp, Litopenaeus vannamei, at various salinities. Aquaculture 274, 80–86.
Liang, Z., Liu, R., Zhao, D., Wang, L., Sun, M., Wang, M. and Song, L. (2016). Ammonia exposure induces oxidative stress, endoplasmic reticulum stress and apoptosis in hepatopancreas of pacifc white shrimp (Litopenaeus vannamei). Fish and Shellfsh Immunology 54, 523–528.
Lin, Y.C. and Chen, J.C. (2001). Acute toxicity of ammonia on Litopenaeus vannamei Boone juveniles at diferent salinity levels. Journal of Experimental Marine Biology and Ecology 259, 109–119.
Lin, Y.C. and Chen, J.C. (2003). Acute toxicity of nitrite on Litopenaeus vannamei (Boone) juveniles at diferent salinity levels. Aquaculture 224, 193–201.
Lin, Y.C., Chen, J.C., Li, C.C., Morni, W.Z., Suhaili, A.S.N. et al. (2012). Modulation of the innate immune system in white shrimp Litopenaeus vannamei following long-term low salinity exposure. Fish and Shellfsh Immunology 33, 324–331.
Liu, C.H. and Chen, J.C. (2004). Efect of ammonia on the immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus. Fish and Shellfsh Immunology 16, 321–334.
Liu, F., Li, S., Yu, Y., Sun, M., Xiang, J. and Li, F. (2020). Efects of ammonia stress on the hemocytes of the Pacifc white shrimp Litopenaeus vannamei. Chemosphere 239, 124759.
Liu, L., Hu, Z., Dai, X. and Avnimelech, Y. (2014). Efects of addition of maize starch on the yield, water quality and formation of biofocs in an integrated shrimp culture system. Aquaculture 418–419, 79–86.
Llan, G.L. and Maguire, G.B. (1991). Lethal levels of low dissolved oxygen and efects of short-term oxygen stress on subsequent growth of juvenile Penaeus monodon. Aquaculture 94, 27e37.
Lu, X., Luan, S., Dai, P., Luo, K., Chen, B., Cao, B., Sun, L., Yan, Y. and Kong, J. (2019). Insights into the molecular basis of immunosuppression and increasing pathogen infection severity of ammonia toxicity by transcriptome analysis in pacifc white shrimp Litopenaeus vannamei. Fish and Shellfsh Immunology 88, 528–539.
Madeira, D., Mendonça, V., Dias, M., Roma, J., Costa, P.M. and Larguinho M. (2015). Physiological, cellular and biochemical thermal stress response of intertidal shrimps with diferent vertical distributions: Palaemon elegans and Palaemon serratus. Comparative Biochemistry and Physiology A 183, 107–115.
McGraw, W.J. and Scarpa, J. (2004). Mortality of freshwater-acclimated Litopenaeus vannamei associated with acclimation rate, habituation period, and ionic challenge. Aquaculture 236(1–4), 285–296.
Melzner, F., Mark, F.C., Seibel, B.A. and Tomanek, L. (2019) Ocean acidifcation and coastal marine invertebrates: Tracking CO2 efects from seawater to the cell. Annual Review of Marine Science 12, 499–523.
Mendes, J.P., Coelho, L., Kovacs, B., de Almeida, J.M., Pereira, C.M., Jorge, P.A. and Borges, M.T. (2019). Dissolved carbon dioxide sensing platform for freshwater and saline water applications: Characterization and validation in aquaculture environments. Sensors 19(24), 5513.
Menz, A. and Blake, B.F. (1980). Experiments on the growth of Penaeus vannamei Boone. Journal of Experimental Marine and Biological Ecology 48, 99–111.
Middlemiss, K.L., Urbina, M.A. and Wilson, R. (2016). Efects of seawater alkalinity on calcium and acid-base regulation in juvenile European lobster (Homarus gammarus) during a moult cycle. Comparative Biochemistry and Physiology A 193, 22–28.
Millard, R.S., Ellis, R.P., Bateman, K.S., Bickley, L.K., Tyler, C.R., van Aerle, R. and Santos, E.M. (2020). How do abiotic envrionmetal conditions infuence shrimp susceptibilty to disease? A critical analysis focussed on White Spot Disease. Journal of Invertebrate Pathology 6 April, 107369.
Montgomery-Brock, D.R., Shimojo, R.Y. and Bullis, R.A. (2002). Te reduced impact of Taura syndrome on Litopenaeus vannamei held under hyperthermic conditions. Central, Tropical and Subtropical Aquaculture Aqua Tips 13, 4–7.
Montgomery-Brock, D., Tacon, A.G.J., Poulos, B. and Lightner, D. (2007). Reduced replication of infectious hypodermal and hematopoietic necrosis virus (IHHNV) in Litopenaeus vannamei held in warm water. Aquaculture 265, 41–48.
Morse, J.W. et al. (2007). Calcium carbonate formation and dissolution. Chemical Reviews 107, 342–381.
Moser, J.R., Álvarez, D.A.G., Cano, F.M., Garcia, T.E., Molina, D.E.C., Clark, G.P., Marques, M.R.F., Barajas, F.J.M. and López, J.H. (2012). Water temperature infuences viral load and detection of White Spot Syndrome Virus (WSSV) in Litopenaeus vannamei and wild crustaceans. Aquaculture 326–329, 9–14.
Neufeld, D. and Cameron, J. (1994). Efect of the external concentration of calcium on the postmoult uptake of calcium in blue crabs (Callinectes sapidus). Journal of Experimental Biology 188(1), 1.
Pan, L. and Jiang, L. (2002). Te efect of sudden changes in salinity and pH on the immune activity of two species of shrimps. Journal of the Ocean University of Qingdao 32(6), 903–910.
Pan, L.Q., Zhang, L.J. and Liu, H.Y. (2007). Efects of salinity and pH on ion-transport enzyme activities, survival and growth of Litopenaeus vannamei postlarvae. Aquaculture 273(4), 711–720.
Patterson, B.D. and Torne, M.J. (1995). Measurements of oxygen uptake, heart and gill bailer rates of the callianassid burrowing shrimp Trypaea australiensis Dana and its responses to low oxygen. Journal of Experimental Marine Biology and Ecology 194, 39e52.
Pante, J. R. M. (1990). Infuence of environmental stress on the heritability of molting frequency and growth rate of the penaeid shrimp, Penaeus vannamei. University of Houston-Clear Lake: ProQuest Dissertations Publishing.
Peck, V.L., Oakes, R.L., Harper, E.M., Manno, C. and Tarling, G. (2018). Pteropods counter mechanical damage and dissolution through extensive shell repair. Nature Communications 9, 264.
Perez-Velazquez, M., Bray, W.A., Lawrence, A.L., Gatlin, D.M. and Gonzalez-Felix, M.L. (2001). Efect of temperature on sperm quality of captive Litopenaeus vannamei broodstock. Aquaculture 198, 209–218.
Pfeifer, T.J., Summerfelt, S.T. and Watten, B.J. (2011). Comparative performance of CO2 measuring methods: Marine aquaculture recirculation system application. Aquacultural Engineering 44(1), 1–9.
Ponce-Palafox, J., Martinez-Palacios, C.A. and Ross, L.G. (1997). Te efects of salinity and temperature on the growth and survival rates of juvenile white shrimp, Penaeus vannamei, Boone, 1931. Aquaculture 157, 107–115.
Ponce-Palafox, J., Ruíz-Lunab, A., García-Ulloa Gómez, M., Esparza-Leald H. M., Arredondo-Figueroae, J. L., Martinez-Palaciosf C.A.,& Ross, L.G. (2013) A response-surface analysis of the relative importance of the temperature, salinity and body weight on the respiratory metabolism of the white shrimp Litopeneaus vannamei (Boone, 1931)
Pontinha, V.D.A., Vieira, F.D.N. and Hayashi, L. (2018). Mortality of pacifc white shrimp submitted to hypothermic and hyposalinic stress. Boletim do Instituto de Pesca 44(2).
Pörtner, H.O., Karl, D.M., Boyd, P.W. et al. (2014) Ocean systems. In: Field, C.B. et al. (eds) Climate Change 2014: Impacts, Adaptation, and Vulnerability. Part A: Global and Sectoral Aspects. Contribution of Working Group II to the Fifh Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge, UK and New York, NY, USA, pp. 411–484.
Racotta, I.S. and Hernández-Herrera, R. (2000). Metabolic responses of the white shrimp, Penaeus vannamei, to ambient ammonia. Comparative Biochemistry and Physiology A 125, 437–443.
Racotta, I., Palacios, E. and Mendez, L. (2002). Metabolic responses to short- and long-term exposure to hypoxia in white shrimp (Penaeus vannamei). Marine and Freshwater Behaviour and Physiology 35, 269–275.
Rahman, M.M., Escobedo-Bonilla, C.M., Corteel, M., Dantas-Lima, J.J., Wille, M., Sanz, V.A., Pensaert, M.B., Sorgeloos, P. and Nauwynck, H.J. (2006). Efect of high water temperature (33 °C) on the clinical and virological outcome of experimental infections with white spot syndrome virus (WSSV) in specifc pathogen-free (SPF) Litopenaeus vannamei. Aquaculture 261, 842–849.
Raja, K., Gopalakrishnan, A., Singh, R. and Vijayakumar, R. (2015). Loose shell syndrome (LSS) in Litopenaeus vannamei رشد باز ponds and its efect on growth and production. Journal of Fish and Aquaculture 6(4), 1000151.
Ries, J.B., Cohen, A.L. and McCorkle, D.C. (2009) Marine calcifers exhibit mixed responses to CO2-induced ocean acidifcation. Geology 37(12), 1131–1134.
Rodríguez-Ramos, T., Espinosa, G., Hernández-López, J., Gollas-Galván, T., Marrero, J., Borrell, Y., Alonso, M.E., Bécquer, U. and Alonso, M. (2008). Efects of Escherichia coli lipopolysaccharides and dissolved ammonia on immune response in southern white shrimp Litopenaeus schmitti. Aquaculture 274, 118–125.
Romano, N. and Zeng, C. (2009). Subchronic exposure to nitrite, potassium and their combination on survival, growth, total haemocyte count and gill structure of juvenile blue swimmer crabs, Portunus pelagicus. Ecotoxicology and Environmental Safety 72, 1287–1295.
Romano, N. and Zeng, C. (2010). Changes to the histological gill structure and haemolymph composition of early blue swimmer crab Portunus pelagicus juveniles during elevated ammonia-N exposure and the post-exposure recovery. Aquaculture Research 41, 468–480.
Romano, N. and Zeng, C. (2017). Cannibalism of decapod crustaceans and implications for their aquaculture: A review of its prevalence, infuencing factors, and mitigating methods. Reviews in Fisheries Science and Aquaculture 25(1), 42–69.
Rosas, C., López, N., Mercado, P. and Martínez, E. (2001). Efect of salinity acclimation on oxygen consumption of juveniles of the white shrimp Litopenaeus Vannamei. Journal of Crustacean Biology 21, 912–922.
Rostami, F., Davoodi, R., Nafsi Bahabadi, M., Salehi, F. and Nooryazdan, H. (2019). Efects of ammonia on growth and molting of Litopenaeus vannamei postlarvae reared under two salinity levels. Journal of Applied Aquaculture 31, 1–13.
Sahu, B.C., Adhikari, A.S. and Dey, L. (2013). Carbon, nitrogen, and phosphorus budget in scampi (Macrobrachium rosenbergii) culture ponds. Environmental Monitoring and Assessment 185(12), 10157–10166.
Saksena, D., Gaidhane, D.M. and Singh, H. (2006). Limnology of Kharland (saline) ponds of Ratnagiri, Maharashtra in relation to prawn culture potential. Journal of Environmental Biology 27, 49–53.
Samocha, T.M., Prangnell, D.I., Hanson, T.R., Treece, G.D., Morris, T.C., Castro, L.F. and Staresinic, G. (2017). Design and Operation of Super-intensive Biofoc-dominated Systems for the Production of Pacifc White Shrimp. World Aquaculture Society, Sorrento, Louisiana, USA.
Schuler, D.J., Boardman, G.D., Kuhn, D.D. and Flick, G.J. (2010). Acute toxicity of ammonia and nitrite to pacifc white shrimp, Litopenaeus vannamei, at low salinities. Journal of the World Aquaculture Society 41, 438–446.
Seidman, E.R. and Lawrence, A.L. (1985). Growth, feed digestibility, and proximate body composition of juvenile Penaeus vannamei and Penaeus monodon grown at diferent dissolved oxygen levels. Journal of the World Mariculture Society 16, 333–346.
Small, D.P., Calosi, P., Rastrick, S.P.S., Turner, L.M., Widdicombe, S. and Spicer, J.I. (2020). Te efects of elevated temperature and PCO2 on the energetics and haemolymph pH homeostasis of juveniles of the European lobster, Homarus gammarus. Journal of Experimental Biology 223(8), jeb209221.
Söderhäll, K. and Cerenius, L. (1992). Crustacean immunity. Annual Review of Fish Diseases 2, 3–23.
Su, Y., Feng, C. and Ma, S. (2010). Efects of salinity fuctuation on the growth and energy budget of juvenile Litopenaeus vannamei at diferent temperatures. Journal of Crustacean Biology 30, 430–434.
Nonwachai, T., Purivirojku, W., Chuchird, N. and Limsuwan, C. (2011). Efects of dissolved oxygen levels on growth, survival and immune response of juvenile pacifc white shrimp Litopenaeus vannamei. Journal of Fisheries and the Environment 35(3), 1–10.
Tornber, K., Verner‐Jefreys, D., Hinchlife, S., Rahman, M.M., Bass, D. and Tyler, C.R. (2019). Evaluating antimicrobial resistance in the global shrimp industry. Reviews in Aquaculture 12(2), 966–986.
Tidwell, J.H. (2012). Functions and CCharacteristics of All Aquaculture Systems, 1st edn. John Wiley and Sons, Inc., London.
Timmons, M.B. and Ebeling, J.B. (2013). Recirculating Aquaculture, 3rd edn. Ithaca Publishing Company, Ithaca, New York, USA.
Tseng, I.T. and Chen, J.C. (2004). Te immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus under nitrite stress. Fish and Shellfsh Immunology 17, 325–333.
Van Wyk, P. and Scarpa, J., (1999). Water quality and management. In: Van Wyk, P. et al. (eds) Farming Marine Shrimp in Recirculating Freshwater Systems. Florida Department of Agriculture and Consumer Services, Tallahassee, Florida, USA, pp. 128–138.
Vaquer-Sunyer, R. and Duarte, C.M. (2008). Tresholds of hypoxia for marine biodiversity. Proceedings of the National Academy of Sciences USA 105, 15452–15457.
Verhoef, G. D., Austin, C. M., Jones, P. L. and Stagnitti, F. (1998). Efect of temperature on molt increment and intermolt period of a juvenile australian fresh-water crayfsh, Cherax destructor. Journal of Crustacean Biology 18, 673–679.
Vidal, O.M., Granja, C.B., Aranguren, F., Brock, J.A. and Salazar, M. (2001). A profound efect of hyperthermia on survival of Litopenaeus vannamei juveniles infected with white spot syndrome virus. Journal of the World Aquaculture Society 32, 364–372.
Villarreal, H., Hinojosa, P. and Naranjo, J. (1994). Efect of temperature and salinity on the oxygen consumption of laboratory produced Penaeus vannamei postlarvae. Comparative Biochemistry and Physiology A 108, 331–336.
Wajsbrot, N., Krom, M.D., Samocha, T.M. and Gasith, A. (1990). Efect of dissolved oxygen and the molt stage on the acute toxicity of ammonia to juvenile green tiger prawn Penaeus semisulcatus. Environmental and Toxicological Chemistry 9, 497–504.
Walker, P.J. and Mohan, C.V. (2009). Viral disease emergence in shrimp aquaculture: origins, impact and the efectiveness of health management strategies. Reviews in Aquaculture 1(2), 125–154.
Walker, S.J., Neill, W.H., Lawrence, A.L. and Gatlin, D.M. (2009). Efect of salinity and body weight on ecophysiological performance of the Pacifc white shrimp (Litopenaeus vannamei). Journal of Experimental Marine Biology and Ecology 380, 119–124.
Wang, W.N., Li, B.S., Liu, J.J., Shi, L., Alam, M.J., Su, S.J. et al. (2012). Te respiratory burst activity and expression of catalase in white shrimp, Litopenaeus vannamei, during long-term exposure to pH stress. Ecotoxicology 21(6), 1609–1616.
Wang, X., Li, E., Chang, X., Qin, J.G., Wang, S. and Chen, X. (2016). Growth, body composition, ammonia tolerance and hepatopancreas histology of white shrimp Litopenaeus vannamei fed diets containing diferent carbohydrate sources at low salinity. Aquaculture Research 47, 1932–1943.
Wang, X., Ma, S., Dong, S. and Cao, M. (2004). Efects of salinity and dietary carbohydrate levels on growth and energy budget of juvenile Litopenaeus vannamei. Journal of Shellfsh Research 23, 231.
Wasielesky, W., Furtado, P., Poersch, L., Gaona, C. and Browdy. C. (2015). Alkalinity, pH and CO2: Efects and tolerance limits for Litopenaeus vannamei superintensive biofoc culture system. An abstract of an oral presentation at Aquaculture America 2015, February 19–22, 2015, New Orleans, Louisiana, USA.
Watson, S.A., Fabricius, K.E. and Munday, P.L. (2017). Quantifying pCO2 in biological ocean acidifcation experiments: A comparison of four methods. PloS ONE 12(9), e0185469.
Weiss, R.F. (1974). Carbon dioxide in water and seawater: the solubility of a non-ideal gas. Marine Chemistry 2(3), 203-215.
Whiteley, N.M., Scott, J.L., Breeze, S.J. and McCann, L. (2001). Efects of water salinity on acid-base balance in decapod crustaceans. Journal of Experimental Biology 204, 1003–1011.
Wickins, J.F. (1985). Ammonia production and oxidation during the culture of marine prawns and lobsters in laboratory recirculation systems. Aquacultural Engineering 4, 155–174.
Wurts, W.A. and Durborow, R.A. (1992). Interactions of pH, carbon dioxide, alkalinity and hardness in fshponds. SRAC publication.
Wilson, R.W. (2020). Te efects of CO2 and related water chemistry on fsh: Climate change v. aquaculture. Bulletin of the European Association of Fish Pathologists 40(2), 49–54.
Wood, H.L., Spicer, J.I. and Widdicombe, S. (2008). Ocean acidifcation may increase calcifcation rates, but at a cost. Proceedings of the Royal Society B 275(1644), 1767–1773.
World Bank (2014). Reducing disease risks in aquaculture. World Bank Report no. 88257-GLB.
Wright, P.A. and Wood, C.M. (2009). A new paradigm for ammonia excretion in aquatic animals: Role of Rhesus (Rh) glycoproteins. Journal of Experimetnal Biology 212, 2303–2312.
Wu, R.S.S., Lam, P.K.S. and Wan, K.L. (2002). Tolerance to, and avoidance of, hypoxia by the penaeid shrimp (Metapenaeus ensis). Environmental Pollution 118(3), 351–355.
Wyban, J., Walsh, W.A. and Godin, D.M. (1995). Temperature efects on growth, feeding rate and feed conversion of the Pacifc white shrimp (Penaeus vannamei). Aquaculture 138, 267–279.
Yoo, K.H. and Boyd, C. (1994). Hydrology and Water Supply for Pond Aquaculture. Springer Science + Business Media, Dordrecht, the Netherlands.
Zhang, K., Pan, L., Chen, W. and Wang, C. (2017). Efect of using sodium bicarbonate to adjust the pH to diferent levels on water quality, the growth and the immune response of shrimp Litopenaeus vannamei reared in zero‐water exchange biofoc‐based culture tanks. Aquaculture Research 48(3), 1194–1208.
Zhang, P.D., Zhang, X.M., Li, J. and Gao, T.X. (2009). Efect of salinity on survival, growth, oxygen consumption and ammonia-N excretion of juvenile white leg shrimp, Litopenaeus vannamei. Aquaculture Research 40, 1419–1427.
Zhang, W., Chen, B., Niu, C., Yuan, L., Jia, H. and Storey, K. B. (2019) Response of the Chinese sof-shelled turtle to acute heat stress: insights from the systematic antioxidant defense. Front. Physiol. 10:710.
Zhang, Z.F., Zhang, W.B. and Liu, L.P. (2012). Status and sustainability problems of white leg shrimp Litopenaeus vannamei culture in Zhanjiang [in Chinese with English abstract]. Guangdong Agricultural Sciences 14, 158–160.
Zhou, H., Li, Y., Wei, L., Zhang, Z., Huang, H., Diao, X. and Xiang, J. (2014). Sensitivity of larvae and adult and the immunologic characteristics of Litopenaeus vannamei under acute hypoxia. Journal of Chemistry 2014, 574534.
[1] Malondialdehyde(MDA)
[2] NaHCO3
[3] KHCO3
[4] Na2CO3
[5] K2CO3
[6] NaOH
[7] Ca(OH)2
[8] Ammonia-oxidizing bacteria(AOB)
[9] Nitrite-oxidizing bacteria(NOB)
[10] Non-dispersive infrared(NDIR)
[11] Flame photometry(FP)
[12] Atomic absorption spectrophotometry(AAS)
[13] Ion chromatography systems(ICS)
[14] Ion selective electrodes(ISE)
[15] Ion selective electrodes(ISE)


