متغیرهای مهم شیمی آب برای تولید میگو

چکیده
تولید تجاری میگو افزایش چشمگیری را در رشد در سطح جهان طی چهار دهه گذشته تجربه کردهاست. این توسعه منجر به افزایش و تنوع بیشتر تکنیکهای گسترده تولید برای دربرگرفتن طیف وسیعی از شرایط تولید، سطوح بهرهوری و اجرای نوآوری تکنولوژیکی شدهاست. این توسعه که تولید میگو در محیطهای سرپوشیده داخلی را امکانپذیر ساختهاست، تولید روز افزون میگو در شمار فزایندهای از کشورهای جهان را تسهیل بخشیدهاست. با این وجود، صرفنظر از وضعیت تولید یا سطح نوآوری تکنولوژیکی مورد استفاده، آبزیپروری میگو با چالشهای فراگیری مواجهه است. محرک افزایش شدت تولید و جهانیشدن به معنای آن است که بخش آبزیپروری میگو باید بر چالش بیماریهای مرتبط با شرایط زیربهینه محیطی و متعاقب آن، پیامدهای مضر برای سلامتی غلبه کند تا رشد پایدار تضمین گردد. در این فصل، پارامترهای محیطی کلیدی را ترسیم میکنیم که بر سلامت میگو تاثیرگذار هستند، دامنههای عملیاتی بهینه را برای هر یک نشان میدهند و بر اهمیت استفاده از فیزیولوژی ارگانیسم برای هدایت مدیریت مزرعه در جهت بهینه ساختن بهرهوری در این بخش تاکید دارند. علاوه بر این، در برجسته ساختن جدیدترین قابلیت اندازهگیری استخر و دستکاری پارامترهای محیطی کلیدی، این فصل شکافهای فناوری کلیدی باقیمانده را شناسایی کرده و مسیری را برای تحقیقات آتی، نوآوری و سرمایهگذاری ترسیم میکند که به طرز معناداری توسعه جهانی تولید میگو را بهبود میبخشد.
مقدمه
میگوی سفید غربی، پنائوس وانامی، گونهای از سختپوستان در جهان است که بیشتر از سایر گونهها پرورش یافتهاست. به لحاظ تاریخی، پرورش میگو از تکنیکهای تولید گستردهای استفاده کردهاست که در آنها حیوانات در استخرهای خاکی تحت تکنیکهای چندکشتی سنتی، گونههای متعدد و شاخههای مختلفی که همزمان در تراکم پایین کشت میشوند، پرورش مییابند. چنین تولیدی بر تلاش برای تکرار عملکرد اکوسیستم طبیعی با دستکاری اندک محیط تولید و حداقل ورودیها(مانند غذا) متمرکز است. اکثریت قریب به اتفاق میگوها هنوز در چنین محیطهای استخر در آسیا و آمریکای مرکزی(شش کشور تولیدکننده برتر تایلند، چین، هندوستان، اکوادور، ویتنام و اندونزی هستند) با مساحت تخمینی 2/1 میلیون هکتاری اختصاص یافته به تولید جهانی استخری میگو در سال 2015 تولید میشوند(بوید و مک نوین، 2018). با این وجود، تولید از سمت گسترده به تولید نیمه متراکم، متراکم یا حتی فوق متراکم محصولات تک کشتی(بوید و همکاران، 2018) تحت افزایش تقاضا و جهانیشدن این صنعت در استفاده از این فرصت اقتصادی منحصربفرد تغییر مسیر دادهاست. تولید جهانی میگو به تقریباً 4 میلیون تن در سال 2018 رسید که بیانگر افزایش 3 تا 5 درصدی در مقایسه با سال 2017 است(فائو، 2019)، در حالی که پیشبینی میشود این بخش یک CAGR (نرخ رشد سالانه ترکیبی) 5/2 درصد در طی دوره 5 ساله بعدی را ثبت کند.
از آنجائیکه تمایل به تولید جهانی میگو در قرن چهار برابر شدهاست، توسط دولتهای محلی با هدف بهرهبرداری از این فرصت صادراتی تسهیل یافتهاست. اقدامات پرورشی قراردادی که طبق آنها، شرکتهای صاداتی بزرگ، دانه، غذا و فناوری لازم برای تولید متراکم را برای پرورشدهندگان مقیاس کوچک تامین میکنند، این انتقال به افزایش تولید را امکانپذیر ساختهاند. براساس تولید استخر خارجی رایج، و همچنین امنیت زیستی محدود، رشد سریع این بخش با پیدایش بیماریهای مهلک مانند ویروس سندروم تورا، ویروس سندروم سر زرد، ویروس سندروم لکه سفید، هپاتوپانکراتیت نکروزکننده و بیماری نکروز هپاتوپانکراتیک حاد همراه بودهاست. با تحمیل 6 میلیارد دلار زیان در سال(بانک جهانی، 2014)، بیماری منجر به زیانهای چشمگیری شدهاست که جمعاً تا 40 درصد از گربهماهی سالانه میگوی آب شور و دریایی را به خود اختصاص میدهد(ایسرانگکورا و سی های، 2002). لذا، راهکارهای تکنولوژیکی فوراً برای غلبه بر این چالش و توانمندسازی توسعهی تولید میگو برای متناسب ساختن افزایش پیشبینی شده با تقاضای جهانی مورد نیاز هستند.
طبقهبندی سیستمهای تولید میگو به نحو گسترده مبتنی بر بهرهوری(سیستمهای گسترده، متراکم، نیمه متراکم یا فوق متراکم)، طراحی(سیستمهای داخلی یا بیرونی) و ظرفیت برای تعویض آب(سیستمهای آبزیپروری استاتیک، گردشی یا تعویض جزئی؛ RAS) است. مفهوم شدت آبزیپروری نه تنها شامل توجه به بازده محصول نسبی، بلکه مفهوم گستردهتر ورودی منابع است(تیدول، 2012؛ جدول 11.1 و شکل 11.1). با این وجود، علیرغم تفاوتهای کلیدی بین شرایط تولید، یکی از ویژگیهای تولید تجاری که بین تمامی سیستمهای تولید مشترک است، چالش شرایط محیطی نامساعد مانند دمای آب(هوانگ و همکاران، 2017؛ مادیرا و همکاران، 2015)، pH(هان و همکاران، 2018)، متغیرهای مرتبط با کلسیفیکاسیون(CO2، قلیائیت، کلسیم و منیزیم) (کای و همکاران، 2017؛ لیمونیر و همکاران، 2004)، اکسیژن محلول هان و همکاران، 2018) و شوری(چن و همکاران، 2016؛ Li و همکاران، 2008؛ مک گرو و اسکراپا، 2004؛ وانگ و همکاران، 2016) و پیامدهای بعدی برای بیولوژی، فیزیولوژی میگو، و وقوع پیامدهای زیانآور برای سلامتی است.
جدول 11.1. ویژگیهای سیستم تولید میگو
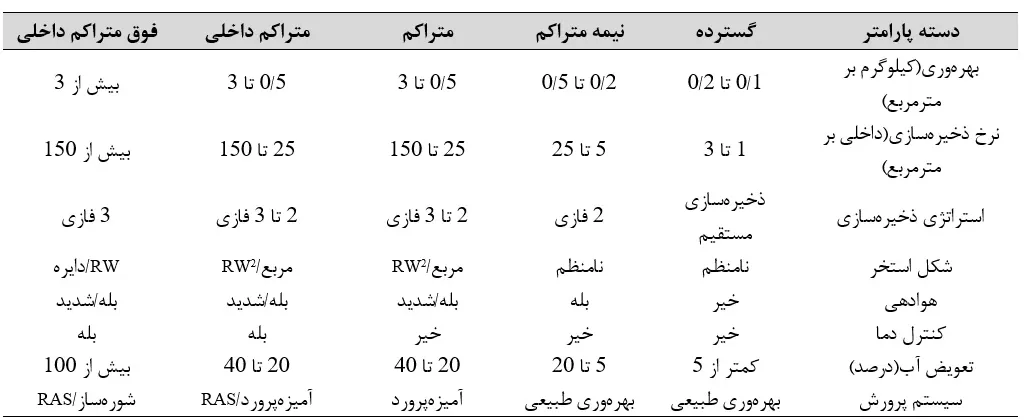

شکل 11.1. سیستمهای مختلف تولید میگو
هدف این فصل، ارائه مروری کلی بر تاثیر شرایط نامساعد محیطی بر فیزیولوژی پی.وانامی و تاکید بر پارامترهای کلیدی در یک حوزه تولید تجاری است. در انجام این کار، هدف این فصل پوشش اطلاعات زمینه در ارتباط با فیزیولوژی میگو و شاخصهای استرس است که به خواننده کمک خواهند کرد درک کند که چرا میگو نیازمند شرایط بهینه برای بیشینه ساختن سلامت و رشد است. این فصل همچنین شواهدی برای این مطلب ارائه خواهد داد که چرا پایش محیط آبزیپروری برای هر وضعیت تولید حیاتی است، نحوه تفسیر دادههای محیطی برای انتخابهای آگاهانه چگونه است و چگونه این اطلاعات را میتوان برای بهبود یا حفظ کارایی یک سیستم مورد استفاده قرار داد.
باقیمانده این فصل به پنج بخش زیر تقسیم شدهاست. سه بخش به پارامترهای محیطی میپردازند که بیشترین تاثیر را بر فیزیولوژی میگو و به دنبال آن حساسیت به بیماری، پیامدهای زیانآور سلامت و بهرهوری در وضعیت تجاری دارند و بصورت زیر پوشش داده میشوند:
بخش 2: دما، شوری و اکسیژن
بخش 3: متغیرهای مرتبط با کلسیفیکاسیون
بخش 4: محصولات دفعی نیتروژندار(آمونیاک، نیتریت و نیترات)
بخشهای 2 و 4، اثرات این پارامترها بر رشد و بهرهوری، بیماری و کارکرد ایمنی، پوستاندازی، متابولیسم، تنفس و تولیدمثل، به همراه نقطه نظراتی درخصوص هرگونه اطلاعات مهم دیگر را بررسی میکنند. بخش 3، متغیرهای محیطی مرتبط با کلسیفیکاسیون را پوشش میدهد و به طور خاص شرح میدهد که چگونه کلسیم، قلیائیت، دی اکسید کربن و منیزیم بر کلسیفیکاسیون پس از پوستاندازی تاثیر میگذارند که در نهایت بر سلامت کل حیوان و بهرهوری یک سیستم تاثیرگذار هستند. در ادامه، بخش 5(مدیریت کیفیت آب) به درک ما از این پارامترهای شیمی آب در یک زمینه تجاری، پایش فراوانی و شناسایی شکافهای کلیدی دانش یا فناوری در ارتباط با پایش محیطی میپردازد. شکافهای کلیدی دانش در کل این فصل، از نقطه نظر درک علمی و قابلیت تکنولوژیکی، در بخش 5 ارائه شدهاست. بنابراین، امید میرود که این فصل برای دانشگاهیان و صنعت بسیار سودمند باشد و ارتباط بین این دو بخش را پوشش دهد و تاکید کند که چگونه جدیدترین درک علمی میتواند منجر به مزایای کلیدی صنعت در یک زمینه تجاری مرتبط شود.
دما، شوری و اکسیژن
پیشزمینه
یکی از دلایل اصلی که میگوهای پی.وانامی بصورت گسترده در آبزیپروری در سطح جهان تولید میشوند، تحمل این گونه در مقابل دامنه وسیعی از شرایط، بخصوص شوری، دما و اکسیژن است. این یک ویژگی اساسی، بخصوص برای پرورش میگو در محیط بیرون است، چنانچه حیوانات در معرض نوسانات شدید محیطی به واسطه خودِ محیط تولید(مانند، منبع آب، تراکم ذخیرهسازی، اجتماع جلبکی، رویههای مدیریت مزرعه) و همچنین تغییرپذیری طبیعی در این پارامترها که در چرخههای روزانه و فصلی رخ میدهند، قرار میگیرند.
دما
میگوها، حیوانات خونسردی هستند، به این معنا که دمای بدن داخلی آنها با محیط بیرون نوسان میکند. پی.وانامی دارای ضریب دمایی بالایی برای رشد است و لذا دمای محیطی یک عامل محرک حاکم بر بقا، سلامت و رشد در آبزیپروری میگو است. در حالی که حجم عظیمی از مطالعات پیشین بر اهمیت درک اثرات دما بر بیولوژی میگو تاکید کردهاند، شکافهای کلیدی در دانش به قوت خود باقی است. برای مثال، تغییر دما در یک وضعیت تولید بعنوان یک عامل کلیدی برای کارکرد ایمنی و سلامت در سایر گونههای تولید اثبات شدهاست. در زمان مواجهه با یک چالش بیماری، تعدادی از گونههای حیوانات ترجیحاً نواحی دمایی خاص را اشغال میکنند؛ پدیدهای که تب رفتاری خوانده میشود(بولتانا و همکاران، 2018). با این وجود، این پاسخ طبیعی مستلزم وجود دامنه دمایی کافی در محیط است. درک این پدیده میتواند پیامدهای مهمی برای طراحی و مدیریت تاسیسات آبزیپروری داشتهباشدکه برای تولید میگو بسیار سودمند هستند.
شوری
میگوی پی.وانامی بعنوان یک گونه شوریپذیر توصیف میشود که دامنه شوری وسیعی را تجربه و تحمل میکند، از آب شیرین با یون ضعیف تا بیش از 40 psu(منز و بلک، 1980). این امر به دامنه وسیعی از محیطها منجر شدهاست که برای پرورش محصول از این گونه مناسب به نظر میرسد. با این وجود، بقا در دو سوی این دامنه با مرحله عمر به دلیل تغییرات در ظرفیت ارگانیسم در تنظیم اسمزی تغییر میکند(چانگ-روبلز و همکاران، 2014).
اکسیژن
با توجه به غلظت اکسیژن محلول، میگوی پی.وانامی در معرض نوسانات طبیعی بزرگی قرار میگیرد و این تغییر در پهنههای آبی که حرکت آب و به دنبال آن اختلاط، کاهش مییابد، بیشتر میشود. در چنین محیطهای ایستایی، که شامل شرایط آبزیپروری گستردهای هستند، DO تابعی از شدت تنفس است که بصورت پیوسته اکسیژن را تخلیه میکند(بخصوص زمانی که زیست توده میکروبی و حیوانی بالا است)، و بصورت متقابل، شدت فتوسنتز در طی ساعات روز زمانی که جلبکها و ماکروفیتها اغلب اکسیژن بیشتری نسبت به تنفس تولید میکنند را برطرف میسازد. مصرف اکسیژن خاص توده توسط پی.وانامی(میلیگرم اکسیژن بر گرم بر ساعت) تحت تاثیر دما، شوری، اندازه[1] و تعامل این پارامترها قرار دارد. به همین دلیل، محیطهای تولید میگوهای تجاری اغلب از سیستمهای هوادهی برقی استفاده میکنند(مانند هوادههای چرخ پاروئی سطحی، شیلنگهای هوادهی غوطهور، سیرکولاتورها، پخشکنندهها یا لولههای ونتوری). پرورش میگو در محیط داخلی معمولاً شدت بالاتری دارد و جلبکها/ماکروفیتها کنار گذاشته میشوند، بنابراین حتی هوادهی(یا اکسیژنه کردن با استفاده از منبعی از اکسیژن خالص تحت فشار) آب برای حفظ سطوح مناسب اکیسژن محلول ضروری است.
رشد و بهرهوری
رشد و بهرهوری و همچنین بقا، نسبت تبدیل غذا و افزایش توده بدنی، شاخصهای عملکرد کلیدی سوددهی در آبزیپروری جهانی هستند. این مقیاسها بصورت منظم پایش میشوند تا این اطمینان حاصل شود که محیط تولید بهینه است. در اینجا شرح میدهیم که چگونه دمای محیطی، شوری و اکسیژن بر عملکرد میگو تاثیر میگذارند و شواهدی را ارائه میدهیم که چرا این پارامترها را باید بصورت دائمی برای بهینهسازی پرورش میگو پایش کرد.
دما
از نقطه نظر دما، نرخ رشد به طور یکپارچه با افزایش دما بالا میرود، حداقل تا زمانی که حیوان به حد دمائی بالای خود میرسد، یعنی هنگامی که رشد قبل از رسیدن به یک دمای بحرانی که در آن مرگ و میر انبوه رخ میدهد، اندکی کاهش مییابد(هارتنول، 2001). همانند تمامی حیوانات، نرخ رشد پی.وانامی مخصوص اندازه است، اما پیشنهاد شدهاست که برای میگوهای نوجوان(جرم اولیه 3/9 گرم)، نابالغ(جرم اولیه 10/8 گرم) و بالغ(جرم اولیه 16 گرم)، کاهش تغذیه و رشد در دماهای بسیار سردتر، در استخرهایی که دما به زیر 23 درجه سانتیگراد افت میکند، رخ میدهد. زمان رشد در دمای 23 درجه سانتیگراد، نرخ رشد ویژه[2] در تمامی دستهبندیهای اندازه/مراحل تولید در مقایسه با همنوعان رشد کرده در دمای 26/2 درجه سانتیگراد کاهش یافت(SGR در دمای بالاتر برای میگوهای نوجوان، نابالغ و بالغ به ترتیب 67، 43 و 56 درصد بود). بدین ترتیب، رشد در دماهای بینهایت سردتر، در میگوهای نگهداری شده در دمای بیش از 30 درجه سانتیگراد، هم کاهش یافت، اما این تاثیر تنها در میگوهای بالغ قابل توجه بود(SGR 78 درصد درمان کنترل، 26/2 درجه سانتیگراد) (وایبان و همکاران، 1995). در میگوهای پستلارو(جرم اولیه تقریبی 0/02 گرم)، SGR در دمای 20 درجه سانتیگراد برابر با 47 درصد بالاترین SGR در عملآوری 25 تا 35 درجه سانتیگراد بود(پونس – پالافوکس و همکاران، 1997). علیرغم تحمل حرارتی گسترده این گونه، پیشنهاد شدهاست که نرخهای رشد بهینه در یک محدوده دمائی بسیار کوچک بین 28 و 30 درجه سانتیگراد رخ میدهد(باکس 11.1).
| باکس 11.1. SGR در کل این فصل، ما اندازهگیریهای SGR، را در صورت امکان، گزارش کردهایم. این اندازهگیریها همگی باید به شیوهای مشابه محاسبه شده باشند(ادامه را ببینید). با این وجود، ذکر این نکته مهم است که در کل تحقیقات پیشین، SGR به شیوههای متفاوتی محاسبه شدهاست. با این وجود، ما معتقدیم که روشهای مختلف محاسبه نتایجی را تولید میکنند که درخصوص تغییر درصد در SGR نسبت به عملآوری کنترل در یک مطالعه مشخص مطمئن هستند. نکته آخر به ما بزرگی اختلاف نرخ رشد را میگوید و تفسیر آن سرراست است و لذا ما این درصدها را در صورت امکان لحاظ کردهایم(برای محاسبات مورد استفاده، ادامه را ببینید). برای این محاسبات، جرم تودههای بدنی نهایی و اولیه و طول دوره رشد، لازم هستند. در نهایت، در زمان بررسی نرخ رشد در تحقیقات پیشین، مدنظر قرار دادن توده بدنی از هر تحقیق مهم است، چون SGR در حیوانات کوچکتر، سریعتر است و لذا ما این موارد را در صورت امکان برای ارائهی زمینه لحاظ کردهایم، چون مقایسههای مستقیم بین مطالعات با استفاده از مراحل مختلف حیات میتوانند گمراهکننده باشند.
|
شوری
میگوی پی.وانامی دارای یک نقطه ایزوسموتیک 25 psu(718 mOsm بر کیلوگرم) است که بعنوان نقطهای تعریف میشود که اسمولالیته داخلی(همولنف) و خارجی یکسان هستند. در تئوری، نقطهای است که در آن، حیوان انرژی کمتری صرف تنظیم اسمزی میکند. با این وجود، به طور غیرشهودی، شوری بهینه برای رشد در میگوها ضرورتاً نقطه ایزوسموتیک نیست، و تحقیقات پیشین نیز دامنه وسیعی از شوری را برای رشد بهینه شرح دادهاند. برای مثال، مقایسهی تفاوتهای دامنههای شوری 5 تا 25 psu(بری و همکاران، 1994؛ روساس و همکاران، 2001) و همچنین 33 تا 40 psu(پونس – پالافوکس و همکاران، 1997) نیز پیشنهاد شدهاست. پونس – پالافوکس و همکاران(1997) نتیجه گرفتند که رشد خوب را میتوان بین 25 و 45 psu به دست آورد. رشد پستلارو(تقریباً 0/1 گرم) در شوریهای بسیار کم(2 و 3 psu) پس از یک آزمایش رشد 35 روزه به ترتیب 57 و 95 درصد بود که همنوعان در 30 psu نگهداری میشدند(لارامور و همکاران، 2001). ذکر این نکته نیز مهم است که اختلافات رشد رخ داده، تنها پس از 18 روز در مطالعهی لارامور و همکاران(2001) به همراه نویسندگانی که هیچ اختلافی را در رشد و بقا گزارش ندادند، در 4 و 30 psu مشاهده شدهاست. چنین روندی بیشتر مورد حمایت دو مطالعه دیگر قرار دارد. والکر و همکاران(2009) نشان دادند که نرخ رشد به طرز معناداری در 2 psu کمتر از 10 یا 28 psu پس از 211 روز بودهاست(وزنهای نهایی برای 2، 10 و 28 psu به ترتیب 20/2، 24/7 و 25/7 گرم بودهاست)، در حالی که وانگ و همکاران(2004) نشان دادند که در 1 تا 16 psu، SGR میگوی سفید، مصرف غذا و کارایی تبدیل غذا همگی با افزایش شوری افزایش یافتهاند.
برای اتخاذ رویکردی متفاوت، در حیات وحش، میگوی پی.وانامی در محیطی با شرایط پایدار سکونت ندارد. نوسانات شوری بین 5 و 10 psu ناشی از آزمایش(هر 4 روز)، با میانگینی حدود 20 psu، نرخ رشد در پی.وانامی را در مقایسه با شوری ثابت 20 psu افزایش دادهاند. بیشترین افزایش در نرخ رشد با نوسانات 10 psu هر 4 روز نشان داده شد، که در آن SGR 31 درصد بالاتر از حالت تحت شرایط پایدار بود(سو و همکاران، 2010). این روند بصورت مکرر اثبات شدهاست و پیشنهاد میشود که نتیجهی مصرف غذای بیشتر، بهبود جذب غذا و کاهش اتلاف انرژی از طریق مدفوع تحت شرایط نوسانی در طی آزمایش تغذیه 48 روزهاست(فنگ و همکاران، 2008؛ سو و همکاران، 2010).
اکسیژن
نشان داده شدهاست که اکسیژن محلول نیز تاثیر معناداری بر رشد میگوی سفید دارد. در یک مطالعه، میگوهای نوجوان(وزن اولیه 0/6 میلیگرم) به طرز معناداری رشد در کمترین فرایند DO (1 میلیگرم بر لیتر) را در مقایسه با درمان DO بالاتر 2، 3 و 4 میلیگرم بر لیتر DO در میانگین دمایی 28 درجه سانتیگراد پس از 16 روز کاهش دادهاست. SGR میگو در درمان 1 میلیگرم بر لیتر اکسیژن محلول تنها 68 درصد SGR میگوی نگهداری شده تحت درمانهای DO بالاتر است(سیدمن و لورنس، 1985). با این وجود، این نویسندگان هیچ اختلافی در رطوبت، محتوای لیپید یا محتوای پروتئین در میگوهای رشد کرده در سطوح مختلف اکسیژن محلول نیافتند(سیدمن و لورنس، 1985).
بیماری و ایمونولوژی(ایمنی شناسی)
آزمایشها نشان دادهاند کارکرد ایمنی و مقاومت بیمهرگان دریایی در برابر بیماری تحت تاثیر دما، شوری و اکسیژن قرار دارد(الیس و همکاران، 2011). در اینجا بحث خواهیم کرد که چگونه این پارامترهای محیطی میتوانند بر حساسیت به بیماری در تولید پی.وانامی تاثیرگذار باشند.
دما
WSSV، TSV و ویروس نکروز هماتوپوئتیک و هیپودرمال عفونی، AHPND و اینتروسیتوزون هپاتوپنایی از جمله پرهزینهترین بیماریها در آبزیپروری میگو هستند(والکر و موهان، 2009). این عوامل ویروسی همگی دارای دامنه دمایی هستند که از دمای میزبان خود فراتر میرود و لذا میگوها همیشه مستعد این عفونتها هستند(میلارد و همکاران، 2020). با این وجود، مشخص شدهاست که رژیمهای دمائی خاص بر بقای میگو تاثیرگذار هستند. برای مثال، بقا از صفر(هیچ بازمانده) در دمای 25/8 درجه سانتیگراد تا 80 درصد در دمای 32/3 درجه سانتیگراد در میگوهای نوجوانان دچار عفونت WSSV افزایش یافت که حاکی از تاثیر مفید هیپرترمی برای این بیماری است(ویدال و همکاران، 2001). این مطلب با نتایج میگوهای دچار چالش TSV و IHHNV همخوانی دارد، که در این چالشها، دماهای بالاتر بالاترین نرخ بقا را رقم زدهاست(مونت گومری- بروک و همکاران، 2002، 2007). علت این بهبود بقا، کاهش توانایی تکرار WSSV در دماهای بالا و یا افزایش در پاسخ ضدویروسی میگوها نهفته است(گرانجا و همکاران، 2006؛ مونت گومری- بروک و همکاران، 2007؛ موسر و همکاران، 2012؛ تاهمن و همکاران، 2006؛ ویدال و همکاران، 2001).
دماهای بالا ممکن است برای پیشگیری از مرگ ناشی از سه ویروس پاتوژنی عمده(WSSV، TSV و IHHNV) مفید باشند، اما میتوانند باعث افزایش حساسیت نسبت به سایر بیماریها شوند. برای مثال، باکتری پاتوژنی ویبریو الجینولیتیکوس باعث افزایش معناداری در مرگ میگوهای سفید تحت درمانهای دمای بالا(32 تا 34 درجه سانتیگراد) در مقایسه با درمانهای دمای کمتر شد(چنگ و همکاران، 2005). در این تحقیق همچنین مشخص شد که در میگوی سفید قابلیت ایمنی زمانی کاهش یافتهاست که آنها از دماهای 27 یا 28 درجه سانتیگراد به بازه 32 تا 34 درجه سانتیگراد انتقال یافتهاند(چنگ و همکاران، 2005).
هر جا که شیب دما برای تعیین ترجیح دمایی میگوهای سفید مورد استفاده قرار گرفت، نشان داده شد که دمای ترجیحی 0/4±26/2 درجه سانتیگراد است(گنزالز و همکاران، 2010). اگرچه این امر معنادار نبود، اما یک روند آرام وجود دارد که وقتی میگوها با دمای بالاتر یا پایینتر سازگار میشوند، دمای ترجیحی نیز در همان مسیر تغییر میکند(گنزالز و همکاران، 2010). سازگاری میگو میتواند ماکزیمم دمای بحرانی(دمایی که میگوها در آن قادر به انجام رفتار صحیح نیستند) را نیز افزایش دهد. برای مثال، تحمل دمایی تا 5/7 درجه سانتیگراد در میگوهای سازگار شده با دمای 32 درجه سانتیگراد در مقایسه با دمای 20 درجه سانتیگراد افزایش یافت(گنزالز و همکاران، 2010).
تب رفتاری با ترجیح دمائی مرتبط است. این همان جایی است که حیوان دمای بدن خود را افزایش یا کاهش (معمولاً افزایش) میدهد تا با یک عفونت مبارزه کند. برای حیوانات همدما(خونگرم) مانند پستانداران، این امر از طریق تغییر تولید حرارت متابولیک آنها محقق میشود. با این وجود، برای حیوانات خونسرد، این امر امکانپذیر نیست، اما دمای بدن را میتوان گاهی اوقات از طریق رفتار تنظیم کرد و حیوان به طور هدفمند به دنبال محیطهای گرمتر و سردتر هستند(ایوانز و همکاران، 2015). اثبات شدهاست که این پدیده به طور طبیعی در دامنه وسیعی از حیوانات از جمله خزندگان، ماهیان و حشرات رخ میدهد، و در میگوها در استخرها نیز مشاهده شدهاست. در اثبات تب رفتاری، میگوها از توانایی کاهش جزئی، یا تقلیل تاثیر بیماری، کاهش نیاز به مداخله انسانی در درمان بیماری که اغلب از طریق تجویز داروهای گران و آلاینده حاصل میشود، برخوردار هستند(تورنبر و همکاران، 2019). این مزیت مثبت بالقوه در ایجاد تب رفتاری در گونههای کلیدی ماهیان مانند ماهی سالمون اقیانوس اطلس نشان داده شدهاست.
شوری
شوری میتواند بر پاسخهای ایمنی به بیماری در میگوها تاثیر بگذارد. میگوی پی.وانامی رشد کرده در شوریهای کم(2/5 و 5 psu) تغییرات را در فعالیت ایمنی نشان دادند و زمانی که با وی.الجینولیتیکوس و WSSV به چالش کشیده شدند، میگوهای پرورش یافته در شوریهای کمتر(2/5 و 5 psu) دارای نرخ مرگ و میر معنادار بالاتری(30 درصد) در مقایسه با میگوهای پرورش یافته در 15 تا 35 psu(76 تا 86 درصد) بودند(لین و همکاران، 2012).
سایر اثرات زیانآور بر میزبان نیز در نتیجه مواجهه با ترکیبی از شرایط محیطی زیربهینه و عفونت رخ میدهند. نرخ رشد پی.وانامی تحت درمانهای شوری بالا(49 psu) کاهش یافت، اما حتی به واسطه عفونت ناشی از IHHNV کندتر نیز شد(میانگین توده اولیه 1/6 و 2/2 گرم برای جمعیتهای غیرعفونی و عفونی). جمعیتهای عفونی رشد کرده در 25 psu دارای یک SGR بودند که 80/8 درصد گروه کنترل غیرعفونی بودند، در حالی که جمعیتهای عفونی رشد کرده در 49 psu دارای یک SGR بودند که 74/5 درصد کنترل غیرعفونی بودند، به این معنا که افزایش شوری تاثیر معناداری از رشد آرام در میگوهای عفونی برجای گذاشت(بری و همکاران، 1994).
اکسیژن
اکسیژن نیز بر عملکرد ایمنی تاثیرگذار است. برای مثال، تمامی پارامترهای ایمنی آزمایش شده از جمله تعداد کل هموسیت، فعالیت فنول اکسیداز، فعالیت بیگانهخواری هموسیتها و فعالیت باکتریولیتیک و ضدباکتریایی همولنف بدون سلول، به طرز معناداری در 3/0 و 1/5 میلیگرم بر لیتر در مقایسه با 5/5 میلیگرم بر لیتر DO در گروه کنترل، در میگوهای پی.وانامی کمتر بودند(فاون و همکاران، 2009). زمانی که دوز زیرپوستی سویه پاتوژنی باکتریوم پاتوژنی ویبریوکامپبلی[3] برای میگوهای پی.وانامی تزریق شد، میگوهایی که در معرض کم اکسیژنی قرار داشتند(PO2 4 کیلوپاسکال در مقایسه کنترل نورموکسی، 19 تا 20/6 کیلوپاسکال) درصد بالاتری از باکتریهای پاتوژنی که درون همولنف و بافتها هنوز قابل پرورش مانده بودند، داشتند(برجنتز و همکاران، 2005). میگوهای پرورش یافته تحت این فرایند کم اکسیژن نیز توزیع گستردهتری از باکتریها را در بافتهای خود نشان دادند و بار باکتریایی بالاتری در اندامهایی مانند هپاتوپانکراس و آبششها وجود داشت(برجنتز و همکاران، 2005). این امر حاکی از آن است که کم اکسیژنی مانعی برای توانایی میگوها در مبارزه با عفونت باکتریایی به شمار میرود.
پوستاندازی و کلسیفیکاسیون
پوستاندازی عمدتاً توسط سیستم غدد درونریز تنظیم میشود و یک پدیده هورمونی با چندین جنبه است که کنترل هورمونی برای آنها مهم است، از جمله تعیین زمان وقوع پوستاندازی، کنترل شروع پوستاندازی نهایی و تعیین زمانبندی پوستاندازی بلوغ(هارتنول، 2001). با این وجود، نمایش اختلال ناشی از تنش پوستاندازی بیانگر پتانسیل محیط تولید در اثرگذاری بر پوستاندازی در میگوها است. اگرچه بسیار محتمل است که چنین تنشی بر کنترل غدد درونریز این فرایند تاثیر بگذارد، اما اطلاعات اندکی درخصوص مکانیسمهای فیزیولوژیکی که به وسیله آنها هورمونهای مختلف در پوستاندازی تحت تاثیر تغییرپذیری محیطی قرار میگیرند وجود دارد. لذا، در زمان توجه به اثرات وابسته به پوستاندازی، این بخش از فصل بر اثرات دما، شوری و اختلال DO بر زمانبندی و رشد مطلق به دست آمده در طی فرایند پوستاندازی به جای کنترل هورمونی آن متمرکز است.
دما
اگرچه دادههای محدودی درخصوص تاثیر دما بر چرخه پوستاندازی در پی.وانامی وجود دارد، شواهدی از تاثیر در سایر دهپایان مانند خرچنگ آب شیرین استرالیا چاراکس دیستراکتور نیز وجود دارد. ورهوف و همکاران(+1998) دریافتند که وقتی دما از 22 تا 25 یا 28 درجه سانتیگراد افزایش مییابد، دوره بین پوستاندازی کوتاه میشود و تا 25 درصد در بالاترین دما در مقایسه با کمترین دما کاهش مییابد. در حالی که این یک نمونه آزمایشی است، اما با این فرضیه عموماً پذیرفته شده همخوانی دارد که دوره بین پوستاندازی و افزایش پوستاندازی(افزایش در اندازه، یا رشد در هر رویداد پوستاندازی) با افزایش دما در سختپوستان کاهش مییابد(هارتنول، 2001). با این وجود، نشان داده شدهاست که دوره بین پوستاندازی دهپایان مستقل از افزایش پوستاندازی است و هر دو فرایند به شیوهای هماهنگ اما هنوز جداگانه تنظیم شدهاند(فریمن، 1990).
شوری
به دنبال تاثیر مثبت شوری نوسانی بر نرخ رشد میگو، فنگ و همکاران(2008) نیز نشان دادند که نوسانات شوری میتوانند تغییری را در طول دوره بین پوستاندازی(و همچنین فراوانی پوستاندازی) ایجاد کنند. در زمان مواجهه با نوسانات شوری فراتر از یک دوره 48 روزه، زمان بین پوستاندازیها(دوره بین پوستاندازی) در میگوها(یعنی نرخ سریعتر پوستاندازی) در مقایسه با همنوعان نگهداری شده تحت شرایط شوری پایدار، کوتاهتر میشود. زمانی که فراوانی و بزرگی نوسانات شوری افزایش یافت، این پاسخ بیشتر شد(فنگ و همکاران، 2008). علاوه بر این، همانگونه که در بالا نشان داده شد، این امر منجر به طرز معناداری میگوهای بزرگتر منجر شد(میگوهای قرار گرفته در معرض نوسان شوری 10 psu هر 4 روز 42 درصد بزرگتر از همنوعان گروه کنترل تحت شرایط پایدار 20 psu بودند) (فنگ و همکاران، 2008).
شوری به طرز مشهودی بر تنظیم اسمزی تاثیرگذار است و فرایند پوستاندازی تاثیر نیز آشکاری بر تنظیم اسمزی دارد. ظرفیت تنظیم اسمزی[4] را میتوان بعنوان اختلاف بین فشارهای اسمزی همولنف و محیط خارجی در یک شوری مشخص تعریف کرد. این ظرفیت برای شناسایی تنش در سختپوستان مورد استفاده قرار گرفتهاست و قبل و بعد از پوستاندازی کاهش مییابد و در شوری 35/5 psu در طی این مراحل تقریباً ایزوسموتیک میشود که نشان میدهد میگوها توانایی حفظ شیبهای اسمزی بزرگ در طی این نقاط کلیدی در چرخه عمر خود را از دست میدهند(چارمانتیر و همکاران، 1994). فوق OC و زیر OC که به ترتیب در شوری پایین و در آب دریا اندازهگیری شدند، پس از مواجهه 1 تا 2 روزه با تنش اکسیژن کم[5] سرکوب شدند.
کلسیم یکی از مولفههای حیاتی کلسیفیکاسیون اسکلت خارجی جدید پس از پوستاندازی است و سختپوستان این یون را از آب خارجی میگیرند(بخش 3 را ببینید). غلظتهای محیطی کلسیم محلول بصورت طبیعی عمدتاً در تناسب با شوری تغییر میکنند و لذا هرگونه تاثیر شوری متغیر بر پوستاندازی ممکن است تاحدودی مربوط به موجودی کلسیم باشد. با این وجود، موجودی کلسیم آب شیرین، آب شور و آب دریا میتواند مستقل از شوری متغیر باشد، بخصوص در محیطهای مصنوعی مانند آبزیپروری(بخش 3 را ببینید). سایر استراتژیهای کاهشی نیز ممکن است بر این رابطه تاثیرگذار باشند؛ برای مثال، هر جا که کاهش در pH از طریق افزودن مواد قلیائی مانند کلسیم اکسید بافر شود، رابطه بین شوری و کلسیم تغییر خواهد کرد و لذا تاثیری بالقوه بر کلسیفیکاسیون خواهد داشت. در نتیجه، در زمان استنباط تاثیر شوری بر پوستاندازی و تلاش برای جدا کردن تاثیر غلظتهای کلسیم و شوری، بخصوص جایی که ترکیب یونی آب تولید بصورت مصنوعی، خواه عمدی یا غیرعمدی، دستکاری میشود، باید دقت لازم را در نظر گرفت. زمانی که این ملاحظه در تحقیقات علمی گستردهتر نادیده گرفته میشود، استانداردسازی بین مقالات و جداسازی تاثیر این دو پارامتر دشوار خواهد بود. برای اطلاعات بیشتر درخصوص تاثیر ترکیب یونی آب تولید بر بیولوژی میگو ادامه را ببینید.
اکسیژن
زمانی که تاثیر DO بر پوستاندازی مدنظر قرار میگیرد، توجه به این امر مهم است که مصرف اکسیژن در طی چرخه پوستاندازی در میگوی سفید تغییر میکند و مصرف اکسیژن بیشتر بلافاصله پس از پوستاندازی در 0/5 و 30 psu قابل توجهاست(دینگ و همکاران، 2014). نویسندگان این فرضیه را مطرح میسازند که این افزایش در مصرف اکسیژن پس از پوستاندازی به دلیل افزایش تقاضای انرژی برای کلسیفیکاسیون است(دینگ و همکاران، 2014). این امر حاکی از آن است که تحمل میگوها در برابر غلظتهای کمتر اکسیژن محلول ممکن است بسته به مرحله پوستاندازی حیوان، متفاوت باشد.
فیزیولوژی تنفسی و متابولیسم
دما
بخشی عمدهای از هموستاز شامل حفظ یک pH داخلی پایدار، تحت عنوان تعادل اسید – باز، است، چنانچه واکنشهای آنزیمی که درون سلولها رخ میدهند عملکردی بهینه درون یک محدوده pH دارند. این امر به دلیل حساسیت pH در ساختار سهگانه و به دنبال آن کارکرد تقریباً تمامی پروتئینها است. pH داخلی یک ارگانیسم تحت تاثیر مستقیم عوامل داخلی و خارجی خاصی قرار دارد، و سختپوستان به این چالشها از طریق انتقال مولکولهای مرتبط با اسید – باز در سطح غشاهای سلول برای حفظ pH داخلی در محدود یا نزدیک به پنجره کارکرد بهینه پاسخ میدهند(وایتلی و همکاران، 2001). شوری تاثیری کلیدی بر تعادل اسید – باز دارد و شواهد حاکی از آنند که تنظیم اسید – باز در سختپوستان دهپا در نتیجه شوری به تنظیم حجم سلول ارتباط دارد(وایتلی و همکاران، 2001). برای مثال، شوری کم باعث آلکالوز متابولیک میشود در حالی که شوری بالاتر منجر به اسیدوز متابولیک در همولنف خرچنگهای شوریپذیر میشود. در ضمن، زمانی که تغییرات در پارامترهای محیطی حیوان را مجبور به پاسخ فعال میکنند، انرژی برای حفظ هموستاز مصرف میشود که انرژی را از سایر فرایندها مانند رشد و کارکرد ایمنی دور میکند. این درست نمونه دیگری از این امر است که چرا حفظ محیط بهینه، کارایی انرژی و همچنین رشد میگوها را بهبود میبخشد.
با روی آوردن به پایش مصرف انرژی به شکل متابولیسم، مصرف اکسیژن بصورت گسترده بعنوان یک پراکسی برای نرخ متابولیک در دامنه وسیعی از ارگانیسمها، به دلیل کاربرد نسبی اندازهگیری و نقش کلیدی آن در تبدیل انرژی به شکل مفید درون سلول در طی تنفس هوازی، مورد استفاده قرار میگیرد. در نتیجه، این بخش عمدتاً به این بحث میپردازد که چگونه دما، شوری و اکسیژن محلول بر مصرف اکسیژن تاثیر میگذارند.
زمانی که دما افزایش مییابد، مصرف اکسیژن میگوی پی.وانامی نیز افزایش مییابد. مقادیر ضریب دما[6] کمتر از 2 با یک تغییر دمای خارجی از 20 تا 30 درجه سانتیگراد گزارش شدهاست و مقدار میانگین Q10 برابر با 1/81 را مشخص میکند که برای بسیاری از حیوانات خونسرد آبزی، عادی است(کلارک و جانستون، 1999). با این وجود، بیش از 30 درجه سانتیگراد، مقدار Q10 تا 1/14 کاهش یافت که با نزدیک شدن دماها با آستانه بحرانی، روندی عادی به شمار میرود. زمانی که اندازه میگوها از 1 تا 10 گرم افزایش مییابد، مصرف اکسیژن خاص توده آنها[7] نصف میشود، اما هیچ اختلاف معناداری بین میگوهای 10 و 20 گرمی مشاهده نشد(پونس – پالافوکس و همکاران، 2013) (باکس 11.2).
یک Q10 اندکی بالاتر به میزان 2/27 برای پی.وانامی در دمای 20 تا 32 درجه سانتیگراد گزارش شد و با ترجیح دمایی 26 درجه سانتیگراد به نظر همخوانی داشت(ویلاریل و همکاران، 1994). این مطلب با مطالعه بعدی که در آن ترجیح رفتاری برابر با 26 درجه سانتیگراد شناسایی شد نیز تایید گردید(گنزالز و همکاران، 2010).
شوری
تاثیر شوری بر مصرف اکسیژن شفافیت کمتری دارد و برخی مطالعات حاکی از تاثیر حاشیهای بر مصرف اکسیژن هستند(ویلاریل و همکاران، 1994؛ و الکر و همکاران، 2009). سایر مطالعات نشان میدهند که مصرف اکسیژن در شوریهای کمتر از 5 psu در مقایسه با 30 psu افزایش یافت(دینگ و همکاران، 2014؛ روساس و همکاران، 2001). اختلاف بزرگی نیز در مصرف اکسیژن پس از تغذیه منطبق با شوریهای مختلف وجود دارد: در 5 psu، مصرف اکسیژن تا 134 درصد افزایش یافت(در مقایسه با سازگاری سریع گروه کنترل با همان شوری)، در حالی که در 15 و 30 psu، افزایش معنادار کوچکتری، 89 و 51 درصد، مشاهده شد(روساس و همکاران، 2001). محققان پیشنهاد میدهند که این الگو ناشی از افزایش نیاز به انرژی برای حفظ هموستاز در 5 psu است، که با افزایش مصرف اکسیژن در مقایسه با 15 و 30 psu نیز نشان داده شدهاست.
| باکس 11.2. Q10 برای حیوانات خونسرد، Q10 رابطه نمائی بین متابولیسم و دما را توصیف میکند، بخصوص افزایش نسبی در نرخ متابولیک برای هر 10 درجه سانتیگراد افزایش در دما. نرخ متابولیک با افزایش دما بالا میرود، و لذا مقدار Q10 بلاتر از 1 خواهد بود و مقادیر Q10 برای حیوانات خونسرد حدود 2 هستند؛ این بدان معناست که وقتی دما تا 10 درجه سانتیگراد افرایش مییابد، نرخ متابولیک دوبرابر خواهد شد. برای تفسیر Q10، درک این نکته مهم است که هر چقدر این مقدار بالاتر باشد، منحنی نرخ متابولیک در ارتباط با افزایش دما نیز شدیدتر خواهد بود و بالعکس. زمانی که دما از بهینه حیوان فراتر میرود، پیکهای متابولیسم با نزدیک شدن بهینه به حد کشنده بالایی کاهش مییابند، و اغلب برای نمایش حساسیت ارگانیسمها در مقابل تغییر دما به کار میرود. نرخ متابولیک را میتوان به چند شیوه اندازهگیری کرد، اما معمولاً میتوان بصورت مصرف اکسیژن آن را پایش کرد، زیرا اکسیژن برای مسیرهای متابولیک هوازی ضروری است. Q10 معمولاً با استفاده از معادله زیر محاسبه میشود: Q10 = (rate2 ÷ rate1)10 ÷ (temp2 – temp1) Rate1: نرخ مصرف اکسیژن در دمای 1 Rate2: نرخ مصرف اکسیژن در دمای 2 Temp1: دمای کمتر Temp2: دمای بالاتر |
اکسیژن
میگوی سفید میتواند در مقابل کم اکسیژنی متوسط با استفاده از سازگاریهای فیزیولوژیکی از جمله متابولیسم غیرهوازی(حداقل برای دورههای کوتاه) و افزایش تهویه و ظرفیت حمل اکسیژن مقاومت کند(راکوتا و همکاران، 2002). پس از مواجه میگوها با کم اکسیژنی متوسط 02 تا 2/6 میلیگرم بر لیتر اکسیژن محلول) برای 3 یا 14 روز، مشخص شد که میگوها مس را از درون هپاتوپانکراس برای سنتز هموسیانین مازاد جمع میکنند که ظرفیت حمل اکسیژن را در مقایسه با میگوی نگهداری شده تحت نورماکسی(میانگین 6/1 میلیگرم بر لیتر اکسیژن محلول) افزایش میدهد. این نویسندگان شاهد افزایش سطوح گلوکز و لاکتات در همولنف بودند که نشانهای از متابولیسم غیرهوازی است(راکوتا و همکاران، 2002).
تولید
اهمیت کیفیت تولیدمثل برای آبزیپروری در نهایت به سرنوشت مدنظر میگو وابسته است(حیوانات ذخیره مولدین در مقابل مصرف انسانی). لذا، این بخش رابطهای بیشتری در زمان مدنظر قرار دادن در زمینه حیوانات ذخیره مولدین نسبت به حیوانات تولید شده برای رشد باز و بازاری که انرژی اختصاص یافته به تولیدمثل در آن از رشد جسمی فاصله میگیرد، وجود دارد. در حال حاضر، کمبود تحقیقات درخصوص اثرات شوری و غلظت اکسیژن بر تولیدمثل در میگوهای پی.وانامی یا در حقیقت در سایر گونههای میگو احساس میشود، و لذا ما بر اطلاعات محدودی متمرکز میشویم که برای مثال در پژوهش هارلیاوغلو و همکاران(2019) حول اثرات دما بر تولیدمثل پی.وانامی وجود دارند.
دما
در میگوی نر پی.وانامی(48 گرم) که تحت شوری 36 psu نگهداری میشود، زمانی که میگوها به مدت 42 روز در دماهای ثابت 29 درجه سانتیگراد(0/1 میلیون سلول) یا 32 درجه سانتیگراد(هیچ سلول اسپرم کاملی وجود ندارد، تنها قطعاتی یافت شدند) در مقایسه با 26 درجه سانتیگراد(18/6 میلیون سلول) نگهداری شدند، میانگین تعداد اسپرم در هر اسپرماتوفور ترکیبی به طرز معناداری کاهش یافت(پرز- ویلازکوز و همکاران، 2001). درصد کمتری از ناهنجاریهای اسپرم در 26 درجه سانتیگراد 36/7 درصد) در مقایسه با 29 درجه سانتیگراد وجود داشت(پرز- ویلازکوز و همکاران، 2001).
نتیجهگیری
برای جمعبندی، دما، شوری و غلظت اکسیژن هر کدام اثرات معناداری بر بیولوژی میگوی سفید دارند و در زمان پرورش این گونه بایستی آنها را به دقت مدنظر قرار داد. درخصوص دما، رایجترین نقطه بهینه در تحقیقات موجود به نظر میرسد 26 درجه سانتیگراد باشد. شوری بسته به شرایط دیگر انعطافپذیری بیشتری دارد، اما نقطه بهینه بین 20 تا 25 psu پیشنهاد میشود. اکسیژن محلول پایین نیز به وضوح رشد و سایر کارکردهای فیزیولوژیکی زیر یک مینیمم بحرانی را محدود میکند. طبق تحقیقات اندک موجود، این تصور وجود دارد که سطح اکسیژن محلول بهینه برابر با 4 الی 5/5 میلیگرم بر لیتر یا بیشتر است. برای مقایسه، DO آب 100 اشباع شده با هوا در دمای 26 درجه سانتیگراد و شوری 25 psu برابر با 7/15 میلیگرم بر لیتر است. اگرچه اکسیژن بسیار زیاد میتواند برای بسیاری از ارگانیسمهای آبزی مشکلاتی را ایجاد کند، حد بالا باید برای میگوی سفید در آبزیپروری تعیین شود.
ذکر این نکته مهم است که تحقیقاتی که به موضوع بالا پرداختهاند ممکن است تمامی مراحل حیات و سویههای گونهی میگوی سفید را نشان ندهند. تحمل حرارتی در میگوها میتواند تغییرپذیر باشد به این معنا که دماهای بهینه میتوانند بسته به دمای سازگاری پیشین آنها تغییر کنند.
متغیرهای مرتبط با کلسیفیکاسیون(CO2، pH، قلیائیت، کلسیم منیزیم)
پیشزمینه
برای امکان رشد(یعنی افزایش فیزیکی در اندازه و محتوای انرژی)، تمامی سختپوستان باید پوستاندازی کنند. این مطلب به معنای ریختن اسکلت خارجی قدیمی و تولید اسکلت جدید است که نیازمدن سفت شدن سریع قبل از حفاظت کامل در سطح بیرونی بدن آنهاست. علاوه بر این، بخشهای دهانی باید قبل از قوی شدن به اندازه کافی برای مصرف غذا سفت شوند. در حالی که اسکلت خارجی جدید نرم میماند، میگوها(مانند تمامی سختپوستان) در مقابل آسیب فیزیکی همنوعخواری و شکارچیان و همچنین تهاجم ارگانیسمهای بیماری و انگلها آسیبپذیرتر هستند و بصورت بالقوه حساسیت بیشتری به جذب آلایندههای شیمیایی پیدا میکنند. در آبزیپروری میگو، نرخهای بسیار بالای پوستاندازی(هر چند روز در مراحل اولیه) به همراه تراکمهای ذخیرهسازی بالا(که شانس مواجهه خشونتآمیز با همنوعان را به حداکثر میرساند)، شانس همنوعخواری را افزایش میدهند که یک علت عمده برای زیانهای تجربه شده در آبزیپروری میگو به شمار میرود(زنگ و رومانو، 2017). این بخش بر متغیرهای شیمی آب که تاثیر مستقیمی بر کلسیفیکاسیون پس از پوستاندازی دارند و باید از پتانسیل مدیریت برای بهبود سلامت و رشد میگوها در آبزیپروری برخوردار باشند، متمرکز است.
کلسیم و قلیائیت
در ابتدا، اجازه بدهید مبانی فرایند شیمیایی کلسیفیکاسیون را شرح دهیم. بلافاصله پس از پوستاندازی، میگوها نیازمند مقادیر بالایی یونهای کلسیم(Ca2+) و یونهای کربنات(CO32-) برای کلسیفیه شدن سریع اسکلت خارجی خود هستند، یعنی سفت شدن آن از طریق قرار گرفتن مواد معدنی کلسیم کربنات درون کوتیکول.
![]()
در حالی که تنها یک شکل از یون کلسیم(Ca2+) وجود دارد، یونهای کربنات(CO32-) را میتوان با پروتونزدائی یونهای بیکربنات(HCO3–) تامین کرد که بصورت همزمان یونهای هیدروژن(H+) را آزاد میکند:
![]()
در سختپوستان دریایی، بخش اعظم یونهای کربنات و کلسیم مورد استفاده برای کلسیفیکاسیون به سرعت از طریق آبششها از آب دریای خارجی بلافاصله پس از پوستاندازی جذب میشوند. در نظریه، میگوها میتوانند یونهای کربنات را برای کلسیفیکاسیون از طریق جذب یونهای بیکربنات(HCO3–) یا یونهای کربنات(CO32-) از آب خارجی کسب کنند، اما بیکربنات معمولاً مولکول انتقال یافته در سطح این غشاهای سلولی در نظر گرفته میشود. با این وجود، استفاده از یونهای بیکربنات بعنوان منبع اصلی آب دریا برای کلسیفیکاسیون مستلزم آن است که پروتونها(تولید شده از واکنش در معادله 2) بایستی به سرعت توسط آبششها دفع شوند. لذا، کلسیفیکاسیون پس از پوستاندازی به نرخ بالای دفع اسید ارتباط دارد(که دارای تاثیری مشابه با جذب باز برحسب شیمی اسید – باز است). در دامنه نرمال برای pH آب دریا(مثلاً 7/9 تا 8/3)، اکثریت قریب به اتفاق کربن غیرآلی به شکل یونهای بیکربنات است و لذا انتقال آبشش به منظور کلسیفیکاسیون اسکلت خارجی اغلب بصورت ریزش یا جذب بیکربنات اندازهگیری میشود. روی هم رفته، غلظت یونهای بیکربنات و کربنات بعنوان قلیائیت کربنات شناخته میشوند.
شدت پوستاندازی در سیستمهای آبزیپروری تراکم بالا آنقدر بالاست که میتواند کلسیفیکاسیون پس از پوستاندازی را با حذف کلسیم و یونهای کربنات/بیکربنات در چارچوبهای زمانی نسبتاً کوتاه را محدود کند. یک تاثیر مهم کمی بر قلیائیت آب(و کلسیفیکاسیون میگو) ناشی از میکروبهای شورهساز درون واحدهای بیوفیلتراسیون RAS است. این میکروبها یک مولفه اساسی از سیستمهای پشتیبان حیات را ایجاد میکنند که کیفیت آب سالم را حفظ میکند، اما قلیائیت آب دریا در فرایند تبدیل آمونیاک دفع شده توسط حیوانات به نیترات ایمنتر را تخلیه میکند(ایشچار، 2006).
چندین پژوهش درخصوص گونههای سختپوستانی غیر از میگوها نشان دادهاند که جذب بیکربنات میتواند به طرز محسوسی تحت شرایط قلیائیت پایین آب دریا دچار اختلال شود(مثلاً در لابستر اروپایی(میدلمیس و همکاران، 2016) و خرچنگ آبی(کامرون و وود، 1985)). براساس یک مطالعه پایلوت در دانشگاه اکسرت، ما به تازگی تایید کردهایم که قلیائیت آب دریا تاثیر چشمگیری بر کلسیفیکاسیون در میگوی سفید دارد، به نحوی که سینتیک میکالیس-منتن[8] را دنبال میکند؛ یعنی نرخ جذب بیکربنات(و بنابراین کلسیفیکاسیون) با افزایش غلظت آب از صفر به سرعت افزایش مییابد، اما سپس شروع به هموار شدن میکند(شکل 11.2). زمانی که قلیائیت آب دریا بیشتر افزایش مییابد، افزایش بسیار کم در نرخ جذب و کلسیفیکاسیون به دست میآید(ویلسون، الیس،رایت، 2019، منتشرنشده).
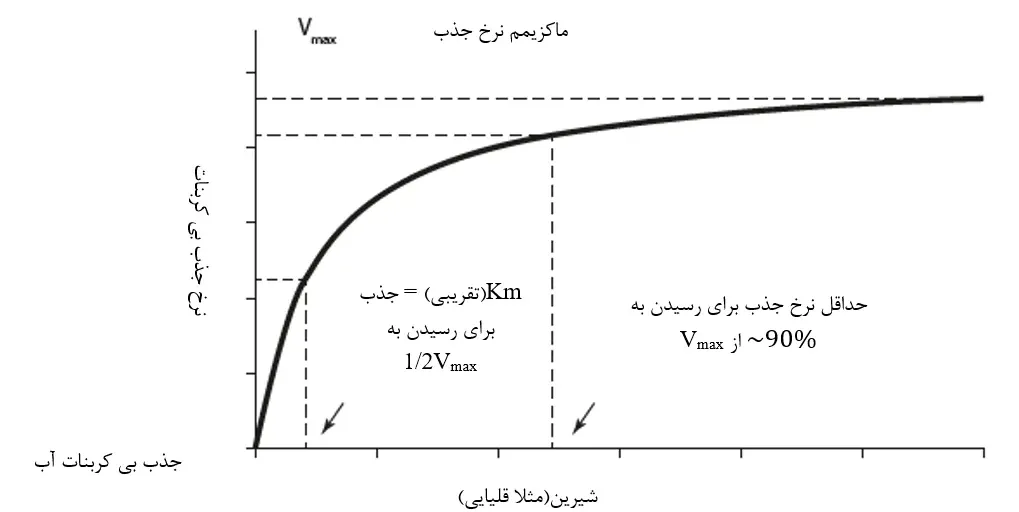
شکل 11.2. رابطه بین جذب بیکربنات از آب دریای خارجی و غلظت بیکربنات موجود در آن. این رابطه شکل یک منحنی سینتیک کلاسیک میکالیس منتن را برای جذب یون در حیوانات آبزی دنبال میکند؛ یعنی، افزایش بسیار شدید در جذب با افزایش غلظت از صفر، اما جذب به سرعت به یک سطح صاف از جذب ماکزیمم نزدیک میشود، و بهره بسیار کمی با افزایش غلظتهای محیطی حاصل میشود. سیستم انتقال یون بصورت کمی با دو پارامتر تعریف میشود: Vmax(ماکزیمم نرخ جذب در جایی که منحنی صاف میشود) و km(غلظتی که به 50 درصد Vmax میرسد، که عکس وابستگی برای یون است(یعنی، هرچقدر Km کمتر باشد، وابستگی بیشتر است).
این مطلب نشان میدهد که یک دامنه بهینه برای قلیائیت وجود دارد(مثلاً حدود 90 درصد Vmax) که جذب سریع بیکربنات از آب و به دنبال آن کلسیفیکاسیون اسکلت خارجی پس از پوستاندازی را تضمین میکند. همین امر برای یونهای کلسیم نیز صادق است(مانند خرچنگ آبی؛ نوفلد و کامرون، 1994). برای مدیریت تولید میگو مهم است که در غلظتهای بالاتر آب دریا برای یون، هیچ مزیتی برای کلسیفیکاسیون وجود ندارد. در حقیقت، به دلیل رابطه قلیائیت بالا با pH بالا، احتمالاً مشکلاتی وجود دارند که احتمال سمیت آمونیاک را بالا میبرند. در ضمن، غلظتهای بالای بیکربنات و کلسیم میتواند منجر به تهنشینی مواد معدنی کربنات ناخواسته درون سیستم آبزیپروری، گرفتگی لولهها و نیاز به افزایش نگهداری پمپهای غوطهور و … شود. علاوه بر این، افزایش قلیائیت و کلسیم با تعیین دوز نمکهای قلیائیی و کلسیم بالاتر از دامنه بهینه یک هزینه مالی بدون بهبود بهرهوری را تحمیل خواهد کرد. لذا، درک ماهیت دقیق این منحنی(بخصوص وابستگی [Km] و کمترین غلظت مورد نیاز برای دستیابی به نرخهای جذب نزدیک به ماکزیمم [Vmax]) برای کلسیم و قلیائیت، برای مراحل مختلف چرخه عمر میگو، اطلاعات ارزشمندی برای پشتیبانی از مدیریت شواهد محور کیفیت آب در جهت ارتقای کلسیفیکاسیون سریع پس از پوستاندازی و سلامت و بهرهوری میگو فراهم میآورد.
کربن دی اکسید
تراکمهای بالای حیوانات مورد استفاده در آبزیپروری به ناچار منجر به تخلیه سریع اکسیژن محلول و افزایش متقابل کربن دی اکسید محلول در نتیجهی متابولیسم هوازی میشود(که مقادیر مولی مشابه این گازها را به ترتیب مصرف و تولید میکند). این رابطه با تراکم حیوان بدان معناست که تاثیر بر این گازهای محلول در پرورش میگوی متراکم نسبت به گسترده تقویت میشود. این مسئله حتی در سیستمهای آبزیپروری گردشی بیشتر تشدید میشود، زیرا علاوه بر خودِ میگوها، میکروبهای بیوفیلتر، متابولیسم هوازی قابل توجهی را انجام میدهند و خودِ فرایند نیتریفیکاسیون O2 را مصرف و CO2 را در تبدیل آمونیاک سمی به نیترات تولید میکند(ایشچار و همکاران، 2006). لذا، فرایندهای تبادل گاز فعال برای بازیابی سطوح مناسب اکسیژن محلول و کربن دی اکسید، فرایند بسیار مهمی هستند که سیستم پرورش میگو را متراکمتر میسازند.
جایگزینی اکسیژن با هوادهی نسبتاً آسان است، و بسیاری از استخرهای پرورش میگو از مکانیسمهای هوادهی برقی استفاده کردهاند(مانند چرخهای پاروئی سطحی، شیلنگهای هوادهی غوطهور، سیرکولاتورها، پخشکنندهها یا لولههای ونتوری). با این وجود، صرفاً به دلیل شیمی فیزیکی، حذف CO2 بسیار دشوارتر از جایگزین O2 است. در ابتدا، CO2 30 برابر انحلالپذیری بیشتری در آب نسبت به اکسیژن دارد(ویس، 1974)، بنابراین ترجیح میدهد در حالت محلول بماند تا اینکه وارد جو شود. دوم اینکه، بیشتر CO2 تولید شده توسط میگوها و میکروبهای بیوفیلتر در ابتدا هیدراته میشود و یونهای کربنات و بیکربنات تولید میکنند که آب را اسیدی میکنند:
![]()
با این وجود، در زمان تلاش برای حذف CO2، واکنش معکوس نسبت به زمان تماس بین هوا و آب در هنگام استفاده از فرایندهای تبادل گاز فعال بسیار آرام است. برای مثال، در آب حاوی اکسیژن پایین/CO2 بالا، بازیابی اکسیژن محلول تنها نیازمند چند دقیقه متعادلسازی هوا است، در حالی که بازیابی کامل اکسیژن محلول نیازمند چندین ساعت زمان است(هاپ و همکاران، 2012). این امر حتی در پیشرفتهترین واحدهای دفع CO2 مورد استفاده در RAS مدرن نیز صادق است. یک عامل پیچیده دیگر آن است که RAS متراکم، آب را با استفاده از اکسیژن خالص(O2 100 درصد) اکسیژنه میکند. از آنجائیکه این آب حاوی پنج برابر اکسیژن در لیتر گاز نسبت به هوا(O2 21 درصد) است، شیب انتشار داخلی و نرخی که در آن اکسیژن محلول را میتوان بازیابی کرد را بهبود میبخشد. با این وجود، این بدان معناست که جریان گاز پنج برابر کمتر برای دستیابی به سطح هدف DO لازم است. متاسفانه این مطلب به این معنا نیز میباشد که CO2 پنج برابر کمتر در زمان استفاده از اکسیژن خالص وارد شده به هوا حذف میشود. تاثیر خالص تمامی این عوامل آن است که CO2 به ناچار مصرف میشود(بخصوص در RAS که از اکسیژن خالص استفاده میکند)، تا زمانی که شیب بین هوا و آب به اندازه کافی برای دستیابی به یک حالت پایدار جدید به دست آید، که همواره یک سطح CO2 بالاتر در آب نسبت به مقدار مورد انتظار برای تعادل با هوای جو است.
در سال 2019، میانگین سطوح CO2 جو 411 میکرو اتمسفر بود(https://www.co2.earth/)، رقمی که بصورت نمائی از زمان انقلاب صنعتی افزایش یافتهاست. این افزایش باعث بروز نگرانی برای حیات آبزی میشود و تاثیر کلی بر شیمی آب تحت عنوان اسیدیشدن اقیانوس شناخته میشود. با این وجود، تمامی محیطهای آبزی روندی مشابه از افزایش CO2 را دنبال میکنند از جمله آب شیرین، پس شاید بهتر باشد که اسیدیشدن آبزی یا حتی کربناته شدن آبزی خوانده شود، چنانچه بسیاری از اثرات بیولوژیکی توسط خودِ CO2 رقم میخورند تا pH محیط آبزی. تا مدتها تصور میشد که افزایش کربن دی اکسید محلول تاثیری مستقیم بر تنظیم یون و اسید – باز، کارکرد تنفسی و عملکرد هوازی در حیوانات آبزی دارد(برونر و همکاران، 2019؛ الیس و همکاران، 2017). سطوح CO2 جو پیشبینی شده برای انتهای قرن حدود 1000 میکرو اتمسفر هستند(پورتنر و همکاران، 2014). با این وجود، سطوح CO2 در آبزیپروری بیش از این مقدار هستند و در دامنه 2.000 تا 45.000 میکرو اتمسفر در طیف وسیعی از سیستمهای باله ماهیان و حلزونهای صدفی قرار دارد. سطح CO2 در سیستمهای پرورش میگو به ندرت گزارش شدهاست، اما میانگین سطح در استخرهای میگوی بنگلادش حدود 17000 میکرو اتمسفر بود(ساهو و همکاران، 2013؛ ساکسنا و همکاران، 2006).
اینکه افزایش CO2 آبزی چه تاثیری بر کلسیفیکاسیون دارد در بسیاری از بیمهرگان مورد مطالعه و بررسی قرار گرفتهاست. اصل بنیادین این است که افزایش CO2 به طور همزمان pH و غلظت یون کربنات در آب دریا را کاهش میدهد. هر ماده کلسیفیه شده که معرض این شرایط آب دریا واقع شدهاست بنا به دو دلیل در خطر است. نخست اینکه، افزایش نرخ خوردگی، یعنی انحلال ماده معدنی کلسیم کربنات به دلیل بازگشت معادله 1. دوم، کلسیفیکاسیون(واکنش جلو در معادله 1) به دلیل عدم وجود یونهای کربنات کند میشود. با این وجود، این واقعیت برای بیشتر ارگانیسمهای کلسیفیهکننده تاحدودی پیچیدهتر است، زیرا میتوانند بر کلسیفیکاسیون در اسکلتهای خارجی آنها کنترل اعمال کنند و مکان کلسیفیکاسیون نیز اغلب درونیسازی میشود، یعنی در تماس مستقیم با آب دریای خارجی نیست. لذا، این شیمی مایعات جسم داخلی آنها و بخصوص مایعات نزدیک به مکانهای کلسیفیکاسیون اسکلت خارجی آنهاست که بیشترین تاثیر را در کلسیفیکاسیون پس از پوستاندازی دارد. علاوه بر این، اسکلت خارجی با یک مولفه آلی پوشانده شدهاست که بصورت بالقوه در مقابل تاثیر مستقیم شیمی آب دریا از آن محافظت میکند. با این وجود، در حال حاضر اطلاعات اندکی درباره هرگونه حفاظت که این لایههای آلی میتوانند فراهم سازند یا درخصوص اینکه آیا بهبود انحلال در یک محیط با CO2 بالا در وهله نخست در بخشهای خارجی یا داخلی اسکلت خارجی کلسیفیه شده رخ میدهد، در اختیار ما است(ملزنر و همکاران، 2019). در حقیقت، این که آیا خودِ پوششهای آلی تحت تاثیر افزایش CO2 در سختپوستان قرار دارند یا خیر نیز نامشخص است و ارزش مطالعه و بررسی دارد(ملزنر و همکاران، 2019).
یک جنبه مهم از مواجهه با CO2 بالا که به خوبی درک شدهاست، تاثیر بر تعادل اسید – باز حیوانات آبزی است. آبششها ضرورتاً دارای نفوذپذیری بالایی برای گازها هستند تا امکان جذب O2 و دفع CO2 فراهم شود. این بدان معناست که وقتی CO2 محیطی افزایش مییابد، به موازات آن CO2 در همولنف نیز افزایش مییابد تا زمانی که یک حالت پایدار جدید با شیبی جدید که برای تحریک انتشار CO2 به سمت بیرون متناسب با تولید درونی حیوان به دست آید. با این وجود، این افزایش در CO2 همولنف منجر به اسیدی شدن درونی در نتیجهی واکنش در معادله 3 میشود. این امر ظرف چند دقیقه بعد از افزایش CO2 محیطی رخ میدهد. با این وجود، با توجه به زمان کافی، بیشتر حیوانات آبزی میتوانند pH همولنف را با فعالسازی فرایندها در آبششهایی که یونهای مازاد H+ را دفع و بیکربنات اضافه را در مایع خارج سلولی جمع میکنند مجدد به حالت نرمال تنظیم کنند(برونر و همکاران، 2019؛ ویلسون، 2020). این جبران pH همولنف برای کارکرد نرمال و سلامت حیاتی است، اما چند ساعت یا چند روز بسته به اینکه سیستمهای تبادل یون در یونوسیتهای آبشش تا چه اندازه میتوانند این یونهای مرتبط با اسید – باز را انتقال دهند، طول میکشد(برونر و همکاران، 2019).
تحت شرایط ثابت CO2 بالا، سختپوستان pH نرمال همولنف را مجدد ایجاد میکنند(برای حفظ شرایط بهینه برای عملکرد تمامی پروتئینها مهم است)، اما با یک تعادل جدید که به وسیله آن هم CO2 و HCO3– در همولنف افزایش مییابند. لذا، در گونههایی که تنظیمکنندههای خوب اسید – باز هستند، غلظت بیکربنات موجود برای مکانهای کلسیفیکاسیون اسکلت خارجی باید در واقع بزرگتر از شرایط CO2 محیطی کم باشد. این امر ممکن است بخشی از تبیین برای گزارشهای فصلی افزایش کلسیفیکاسیون در بیمهرگان دریایی واقع شده در معرض افزایش CO2 باشد(پک و همکاران، 2018؛ وود و همکاران، 2008). درحقیقت، افزایش کلسیفیکاسیون در شرایط ازدیاد CO2(تا 2900 میکرو اتمسفر) برای برخی سختپوستان گزارش شدهاست(مانند میگوی پادشاه شرقی و خرچنگهای آبی؛ ریز و همکاران، 2009)، اما اینکه آیا این روند در سطوح بسیار بالاتری که در پرورش میگو متراکم رخ میدهند(مثلاً 17000 میکرو اتمسفر) کماکان نامشخص است. لازم به ذکر است که وقتی مراحل لارو در آب دریا با افزایش آزمایشی CO2 تنها تا 1200 میکرو اتمسفر پرورش یافتند، لابستر اروپایی دچار کاهش توده کاراپاس و محتوای معدنی(کلسیم و منیزیم) شد(آرنولد و همکاران، 2009). این مسئله میتواند به ناتوانی در انباشت بیکربنات و تنظیم pH همولنف در لابستر در دماهای نزدیک انتهای بالایی دامنهی آنها ارتباط داشتهباشد(اسمال و همکاران، 2020). با این وجود، اینکه میگوی سفید تا چه اندازه میتواند تعادل اسید باز خود را در پاسخ به شرایط CO2 بالا را تنظیم کند یا نحوه تاثیرگذاری دما بر این توانایی، هنوز مشخص نیست.
منیزیم
منیزیم 5/2 برابر فراوانتر از کلسیم در آب دریا است(52 در مقابل 10 mM ) و اغلب در مواد معدنی کلسیم کربنات وارد میشود، یعنی یونهای منیزیم جایگزین یون کلسیم درون شبکه کریستالی میشوند(مورس، 2007). علاوه بر این، تصور میشود که سطوح بالای منیزیم محلول مانع کلسیفیکاسیون میشوند(مورس، 2007) و محتوای Mg اسکلت خارجی سختپوستان نقش مهمی در مقاومت در برابر عفونت باکتریایی ایفا میکند(کونکل و همکاران، 2013). به همین دلیل، پایش محتوای منیزیم آب دریا در آبزیپروری میگو ممکن است سطح بالاتری از درک برای موفقیت پوستاندازی میگو، سلامت و بهرهوری را فراهم سازد. شاید به بیان دقیقتر، نسبت Mg:Ca در آب دریا باید به میزان منیزیم گنجانده شده در اسکلت خارجی ارتباط داشتهباشد. با این وجود، مکانیسمهای بنیادین گنجاندن منیزیم در اسکلت خارجی، و نقش آن در بیولوژی و سلامت میگوها در حال حاضر خام ماندهاند.
آمونیاک، نیتریت، نیترات و فسفات
پیشزمینه
ترکیبات نیتروژن غیرآلی عمده که در آبزیپروری مشاهده شدهاند عبارتند از آمونیاک/آمونیوم(NH3/NH4+)، نیتریت، و نیترات. دو منبع عمده برای این ترکیبات نیتروژندار وجود دارد: محصولات دفعی از خودِ میگوها(در وهله نخست آمونیاک)، و تجزیه میکروبی غذای خورده نشده و آمونیاک محلول دفع شده توسط میگوها(به شکل نیتریت و سپس نیترات). علاوه بر این، ترکیبات حاوی فسفر از طریق مدفوع میگوها دفع شده و از غذاهای خورده نشده/مدفوعها توسط میکروبها آزاد میشوند. میگوی سفید آمونوتلیک است و پسماند نیتروژندار را از طریق آبششها بصورت آمونیاک محلول، شامل 62 تا 84 درصد دفع نیتروژن کل حیوان، دفع میکند(جیانگ و همکاران، 2000). سمیت این ترکیبات نیتروژن از آمونیاک به نیتریت و نیترات کاهش مییابد. پژوهشهای اندکی درخصوص اثرات فسفات بر میگو وجود دارد و بنابراین این مسئله در این فصل پوشش داده نمیشود؛ با این وجود، بدون دادههای بیشتر، هنوز نمیتوان آن را بعنوان یک عامل محدودکننده بالقوه مهم در آبزیپروری میگو کنار گذاشت.
این فرایند تبدیل از آمونیاک/آمونیوم به نیتریت، سپس به نیترات، بعنوان نیتریفیکاسیون شناخته میشود. نیتریفیکاسیون یک مولفه کلیدی در چرخه نیتروژن است و توسط میکروبها در یک فرایند دو مرحلهای انجام میشود که معمولاً با فرمول زیر شرح داده میشود. هر مرحله توسط انواع مختلفی از باکتریها و آرکیها انجام میشود، اما آنها معمولاً در همان محیط رخ میدهند که به همین دلیل است که نیترات، محصول نهایی مشترک در نظر گرفته میشود.
برای آمونیوم:
اکسیداسیون آمونیوم به نیتریت:
![]()
اکسیداسیون نیتریت به نیترات:
![]()
برای آمونیاک غیریونیزه:
اکسیداسیون آمونیاک غیریونیزه به نیتریت
![]()
اکسیداسیون نیتریت به نیترات:
![]()
کل نیتروژن آمونیاک برابر است با مجموع اشکال آمونیوم و آمونیاک غیریونیزه[9]. تناسب نسبی این دو شکل در TAN به دما، شوری و pH آب بستگی دارد. آمونیاک غیریونیزه، سمیترین شکل است، زیرا غشاهای سلولی دارای نفوذپذیری بالایی برای این شکل گازی است، بنابراین وقتی غلظت خارجی بالا است، به سرعت وارد بدن حیوانات آبزی میشود(ایپ و چو، 2010؛ رایت و وود، 2009). با این وجود، در غلظتهای محیطی بالا، یونهای آمونیوم ممکن است مکانیسمهای انتقال سدیم را مختل کنند(آرمسترانگ و همکاران، 1978). نسبت اشکال NH3 و NH4+ در ارتباط با pH بیشترین تغییر را تجربه میکند. زمانی که pH افزایش مییابد، نسبت آمونیاک غیریونیزه افزایش و نسبت آمونیوم کاهش مییابد. تا به اینجا، جایی که دادههای محیطی کافی در مطالعه اصلی ارائه میشوند، مولاریته NH3-N برای نمونههای ارائه شده در این بخش محاسبه شدهاست، بنابراین تمامی مقادیر صرفنظر از شرایط محیطی مستقیماً قابل مقایسه هستند. واحدهای شوری که در این فصل گزارش میشوند برحسب psu استانداردسازی شدهاند.
دفع نیتروژن یک فرایند دینامیک است. میزان دفع(و همچنین غلظتهای حاصل در آب خارجی) و همچنین سمیت برای میگوها میتواند تحت تاثیر عوامل فراوانی قرار بگیرد. نرخ تغذیه بیشترین تاثیر را دارد، چنانچه در نهایت پروتئین رژیمی(و بخصوص آمینواسیدهایی که بصورت مازاد نیاز برای سنتز پروتئین جذب میشوند) است که منبع بیشترین آمونیاک دفع شدهاست. سایر عوامل تاثیرگذار شامل شرایط محیطی، مرحله رشد و مرحله چرخه پوستاندازی هستند(دیاز و همکاران، 2001؛ جیانگ و همکاران، 2000؛ لین و چن، 2001؛ واجسبروت و همکاران، 1990؛ ویکینز، 1985). در نتیجه، ترکیب و غلظت محصولات نیتروژندار در آب تولید میگوی متراکم در دامنهای از مقیاسهای زمانی، از چند دقیقه تا چند روز، متغیر هستند(جکسون و همکاران، 2003).
این بخش به اثرات و پیامدهای مضر سلامتی بر میگو ناشی از افزایش غلظت محصولات دفعی غذایی مانند آمونیاک، نیتریت و نیترات میپردازد. جایی که تحقیقات پیشین درخصوص اثرات ترکیبات نیتروژندار برای میگوی سفید کم هستند، تلاش کردهایم تا از نمونههایی از تحقیقات گستردهتر بر روی گونههای دارای ارتباط نزدیک به هم استفاده کنیم. توجه به این نکته مهم است که بخش غالب تحقیقات، مطالعاتی هستند که از میگوهای نوجوان استفاده میکنند که ممکن است معرف اثرات در طی کل چرخه عمر نباشند.
رشد و بهرهوری
رشد یک شاخص کلیدی از سلامت و بهرهوری در هر سیستم آبزیپروری است و بصورت مکرر مشخص شدهاست که افزایش این محصولات دفعی مغذی در محیط رشد را محدود میکند. در اینجا به چندین نمونه از آسیب رشد میپردازیم که در میگوها در پاسخ به افزایش آمونیاک، نیتریت و نیترات نشان داده شدهاست.
زمانی که مخازن آبزیپروری اشغال شده توسط میگوهای سفید برای تجمع آمونیاک و نیتریت بدون تعویض یا فیلتراسیون آب کنار گذاشته شدند، غلظت آمونیاک و نیتریت هر دو به 1/2 میلیگرم بر لیتر پس از 33 روز رسید(معادل تقریباً 0/05 میلیگرم بر لیتر NH3-N در pH 7/5 تا 8/2). نرخ بقا، افزایش توده و طول و SGR همگی به طرز معناداری کمتری از گروه کنترل بودند(که در آن تعویض و فیلتراسیون آب یک سطح محیطی پایین از TAN کمتر از 0/038 میلیگرم بر لیتر و نیتریت کمتر از 0/032 میلیگرم بر لیتر را حفظ کردند؛ هان و همکاران، 2017). از نقطه نظر بزرگی، SGR به طرز معناداری در میگوهای نوجوان(20 درصد کمتر) در مخازن بدون فیلتراسیون کاهش یافت(هان و همکاران، 2017). یک نتیجه مشابه توسط رستمی و همکاران(2019) نشان داده شد، هرچند در غلظتهای بسیار بالاتر آمونیاک، در میگوهای(میانگین جرم اولیه 0/3 گرم) مواجهه شده با 13 یا 19 میلیگرم بر لیتر TAN در طی 45 روز(معادل 0/49 یا 0/72 میلیگرم بر لیتر NH3-N در pH 7/8)، SGR تا 85 و 79 درصد گروه کنترل کاهش یافت(صفر میلیگرم بر لیتر TAN).
در سیستمهای تعویض آب صفر، مشخص شد که سطوح بالاتر نیتریت رشد در میگوهای نوجوان سفید(میانگین جرم اولیه 8 گرم)، در شوری 24 psu، کاهش مییابد که به موجب آن جرم حاصل پس از 30 روز بصورت خطی با افزایش نیتریت محیطی کاهش مییابد. SGR کل از 10 میلیگرم بر لیتر در این مطالعه 65 درصد گروه کنترل بود(NO2– = 0 میلیگرم بر لیتر) (فورتادو و همکاران، 2016). سطوح نیترات(220 میلیگرم بر لیتر نیترات – N) در شوری 11 psu باعث کاهش بقا، رشد و زیست توده در میگوی سفید شدهاست(کان و همکاران، 2010). نرخ رشد میگوی سفید نوجوان(جرم اولیه تقریبی 1/3 گرم) واقع در معرض غلظتهای نیترات 300 میلیگرم بر لیتر به طرز معناداری کمتر از گروه کنترل(75 میلیگرم بر لیتر نیترات) بود، که به موجب آن SGR گروه آزمایش 85 درصد گروه کنترل بود(فورتادو و همکاران، 2016). تبدیل غذای ظاهری نیز دو برابر شد، از 1/50 تا 3/00 در گروه کنترل و 300 میلیگرم بر لیتر گروه آزمایش (فورتادو و همکاران، 2016).
در میگوی پنائیده دیگر، یعنی پنائوس مونودون، که کاهش رشد را در زمان مواجهه با افزایش TAN نشان میدهد، استقرار مجدد شرایط کنترل منجر به بازیابی نرخ رشد در مقایسه با گروه کنترل پس از یک دوره 30 روزه شد(لین و چن، 1992). این مطلب نشان میدهد، مشروط به کشف و کاهش غلظتهای بالای آمونیاک به اندازه کافی سریع، اثرات بلند مدت را میتوان به حداقل رساند.
برای جمعبندی، طبق تحقیقات فعلی، سطوح ایمن برحسب کاهش زیان بهرهوری از نرخ رشد بصورت زیر است:
- آمونیاک: کمتر از 1/2 میلیگرم بر لیتر TAN(معادل 0/05 میلیگرم بر لیتر NH3-N در pH 7/5 تا 8/2).
- نیتریت: کمتر از 10 میلیگرم بر لیتر N-NO2
- نیترات: کمتر از 200 میلیگرم بر لیتر نیترات – N.
بیماری و ایمونولوژی
حساسیت میگو به بیماریها میتواند به واسطه افزایش محصولات نیتروژندار از طریق القای آپوپتوز سلول و سایر پاسخهای زیانآوری که به بافت و اندام آسیب میرساند، افزایش یابد و لذا در کارکرد نرمال اختلال ایجاد میشود. آمونیاک و استرس نیتریت، که پیشنهاد میشود در سطح 20 میلیگرم بر لیتر TAN رخ دهد(معادل 0/75 میلیگرم بر لیتر NH3-N در pH 8/3) و 20 میلیگرم بر لیتر نیتریت – N، باعث آسیب به رودههای میگوی سفید شدهاند و تنوع باکتریایی رودههای آنها را کاهش داده و در کارکرد مخاطی روده و مولفههای ایمنی مخاط خلل ایجاد میکنند و در نتیجه به کارکرد مانع روده آسیب میرسانند(دان و همکاران، 2018).
شواهدی نیز وجود دارد دال بر اینکه افزایش غلظتهای آمونیاک میتواند باعث ناهنجاریها آبشش شود که میتواند منجر به افزایش حساسیت میگو در مقابل پاتوژنهایی مانند ویروس سندرم لکه سفید شود. آبششها بخش لاینفک دفع آمونیاک(در بین سایر کارکردهای خود) هستند و یک عضو هدف اصلی ویروس سندرم لکه سفید به شمار میرود(اسکوبدو- بونیلا و همکاران، 2007). برای تایید این امر، میگوی سفید واقع شده در معرض غلظتهای ویروس سندرم لکه سفید و TAN 10 میلیگرم بر لیتر(معادل 0/26 میلیگرم بر لیتر NH3-N در pH 8/3) نشان میدهد که سمیت آمونیاک مانع کارکرد ایمنی میشود که منجر به افزایش شدت عفونت میشود(لو و همکاران، 2019). مونودون نیز افزایش حساسیت به ویروس سندرم لکه سفید زمان مواجهه با سطوح پایین TAN تا 1/1 میلیگرم بر لیتر(معادل 0/12 میلیگرم بر لیتر NH3-N در pH 8/35) را نشان داد(فوزی و همکاران، 2010). افزایش مواجهه با نیترات – N(42 روز مواجهه با 300 میلیگرم بر لیتر) نیز باعث آسیب هیستوپاتولوژیکی در آبششهای میگوی سفید شدهاست(فورتادو و همکاران، 2014).
همانند عملکرد رشد، ترمیم و التیام آسیب آبشش ناشی از مواجهه با غلظتهای زیرکشنده آمونیاک – نیتروژن در سایر سختپوستان دهپا مانند خرچنگ شناگر آبی، اثبات شدهاست، زمانی که حیوانات در آب زلال پس از مواجهه قرار گرفتند(رومانو و زنگ، 2010). همچنین نشان داده شدهاست که افزایش غلظتهای نیترات(بیش از 220 میلیگرم بر لیتر) باعث ضایعاتی در هپاتوپانکراس میشود و رخداد گاه به گاه گرفتگی آبشش نیز در میگوی سفید مشاهده شد(کان و همکاران، 2010).
سرکوب کارکرد ایمنی روش دیگری است که طیق آن، محصولات دفعی نیتروژندار میتوانند حساسیت میگو به بیماری را افزایش دهند. هموسیتها، مولفههای جداییناپذیر پاسخ ایمنی یک بیمهره هستند(الیس و همکاران، 2011). در لیتوپنائوس اسچیمیت، غلظتهای TAN به میزان 1±5 میلیگرم بر لیتر(معادل 0/27 میلیگرم بر لیتر NH3-N در pH 8/0) باعث کاهش در تعداد هموسیت به میزان 66 درصد شد(رودریگوز – راموس و همکاران، 2008). در میگوی سفید مواجهه شده با سطوح TAN 20 میلیگرم بر لیتر(معادل 0/28 میلیگرم بر لیتر NH3-N در pH 7/8)، آپوپتوز هموسیت افزایش یافت، که احتمالاً قابلیت ایمنی میگو را کاهش میدهد، و حساسیت به عفونت پاتوژنی افزایش را افزایش میدهد(لیو و همکاران، 2020).
دیگر پارامتر ایمنی کلیدی که بصورت منظم بعنوان شاخصی از استرس در میگوی سفید با چالش آمونیاک استفاده میشود، انعقاد همولنف است. انعقاد همولنف هم از دست دادن بیشتر همولنف را کاهش میدهد و مانع از ورود باکتریها یا سایر میکروارگانیسمها از طریق زخمهای باز میشود(سودرهال و سرنیوس، 1992). نشان داده شدهاست که غلظتهای TAN 5 و 10 میلیگرم بر لیتر(معادل 0/27 و 0/43 میلیگرم بر لیتر NH3-N در pH 7/9) برای تاخیر در زمان انعقاد تا 166 و 218 درصد در مقایسه با میگو از شرایط تحت کنترل(صفر میلیگرم بر لیتر) کافی هستند(چانگ و همکاران، 2015).
میگوی سفید دچار چالش ویبریو الجینولیتیکوس(یک باکتریوم پاتوژنی شایع) حساسیت بیشتری به بیماری داشت و مرگ و میر و سرکوب بالاتری از عفونت ایمنی در زمان قرار گرفتن در آب حاوی غلظتهای TAN بیش از 5/24 میلیگرم بر لیتر(معادل 0/25 میلیگرم بر لیتر NH3-N در pH 8/0) را تجربه کرد(چن و لیو، 2004). پس از 168 ساعت مواجهه با افزایش معنادار غلظتهای TAN (21/6 میلیگرم بر لیتر، معادل 1/04 میلیگرم بر لیتر NH3-N در pH 8/0)، هیچ مرگ و میر میگویی تجربه نشد، در حالی که مرگ و میر جمعی در میگوهای واقع در معرض باکتریها در انزوا(1 در 106 cfu) تحت شرایط کنترل TAN برابر با 47 درصد بود. بالعکس، میگوهای واقع در معرض آزمایش باکتریایی ترکیبی و TAN(5/24 میلیگرم بر لیتر، معادل 0/25 میلیگرم بر لیتر NH3-N در pH 8/0) یک مرگ و میر جمعی 67 درصد را پس از همان دوره 168 ساعته تجربه کردند(چن و لیو، 2004). بدین ترتیب، پس از 168 ساعت، زمانی که با باکتریهای مشابه به چالش کشیده شده و به دنبال آن در معرض سطوح نیتریت – نیتروژن 5/15 میلیگرم بر لیتر قرار گرفتند، مرگ و میر جمعی میگوهای سفید به طرز معناداری در مقایسه با آزمایش کنترل(43 درصد) صرفاً باکتریایی بالاتر بود(70 درصد) (تیسِنگ و چن، 2004). سرکوب یکپارچه ذکر شده در کارکرد ایمنی مشاهده شده در میگوهای مواجهه شده با آزمایشهای نیتریت – نیتروژن بیش از 4/94 میلیگرم بر لیتر پس از 96 ساعت مواجهه وجود داشت(تی سنگ و چن، 2004).
تعیین سطوح ایمن، برحسب کاهش زیان بهرهوری در نتیجه بیماری، دشوار است، زیرا بیشتر شواهد برگرفته از آزمایشهای انجام شده در غلظتهای بالاتر نسبت به آن چیزی که معمولاً در شرایط تولید متراکم تجربه شده یا از سایر گونهها پیشبینی میشود هستند. از تحقیقات کنونی در دسترس، سطوح ایمنی پیشنهادی برحسب کارکرد ایمنی و مقاومت در برابر بیماری به نظر میرسد به شرح زیر باشند:
- آمونیاک: کمتر از 1/1 میلیگرم بر لیتر TAN(معادل 0/12 میلیگرم بر لیتر NH3-N در pH 8/35).
- نیتریت: کمتر از 5/15 میلیگرم بر لیتر نتیرات
- نیترات: کمتر از 177 میلیگرم بر لیتر نیترات – N.
- TAN: کمتر از 1/1 میلیگرم بر لیتر.
پوستاندازی و کلسیفیکاسیون
برای رشد، تمامی سختپوستان باید پوستاندازی کنند و زمانی که اسکلت خارجی سخت قدیمی خود را ریختند، یک پوسته نرم باقی میماند که باید سفت شود تا از شکار و عفونت جلوگیری کند. در میگوی سفید و سایر میگوهای پنائیده، افزایش غلظت آمونیاک بصورت مستقیم فراوانی پوستاندازی را با کاهش دوره بین اولین و دومین پوستاندازی، تا 50 درصد، افزایش دادهاست(چن و کو، 1992؛ چن و لین، 1992؛ رستمی و همکاران، 2019). میانگین دورههای بین پوستاندازی میگوی سفید پستلارو، در شوری 35 psu، مواجهه شده با غلظتهای صفر، 6، 13 و 19 میلیگرم بر لیتر TAN (معادل صفر، 0/23، 0/49 و 0/72 میلیگرم بر لیتر NH3-N در pH 7/8) از 11/5 به 10/8، 9/4 و 8/7 روز کاهش یافت(رستمی و همکاران، 2019). با این وجود، اگرچه فراوانی پوستاندازی به طرز معناداری در گروه کنترل(4/0 گرم) در مقایسه با درمان 19 میلیگرم بر لیتر(2/2 گرم) بالاتر بود(معادل 0/72 میلیگرم بر لیتر NH3-N در pH 7/8) (رستمی و همکاران، 2019). این باید بدان معنا باشد که رشد در هر چرخه پوستاندازی تحت شرایط آمونیاکی بالا، کمتر است که نمیتواند مزیتی برای حیوانات داشتهباشد.
سندروم مرگ پوستاندازی[10] در سختپوستان دهپا از جمله میگوی سفید رخ میدهد و بعنوان مرگی توصیف میشود که ناشی از پوستاندازی ناقص است(مانند گانگ و همکاران، 2004) که به وسیله آن، حیوان قبل از اینکه بتواند اسکلت خارجی قدیمی را بیاندازد، میمیرد. تنش نیتریت(3 میلیگرم بر لیتر NaNO2-N) باعث مرگ و میر ناشی از MDS در خرچنگ شناگر آبی شدهاست(روامنو و زنگ، 2009). اگرچه در حال حاضر کمبود شواهد برای میگوی سفید وجود دارد، این امکان وجود دارد که نتیجهی مشابهی ممکن است در این گونه به دلیل سختپوست دهپا بودن رخ دهد، احتمالی که مستلزم بررسی بیشتر است.
فیزیولوژی اسید – باز، متابولیسم و تنفس
اینکه فیزیولوژی یک ارگانیسم چگونه به تغییر در محیط پاسخ میدهد میتواند بر موجودی انرژی آن برای سایر فعالیتها مانند رشد و تولیدمثل تاثیر بگذارد. پیشبینی اثرات آمونیاک، نیتریت و نیترات بر فرایند هموستاتیک مانند فیزیولوژی اسید – باز، متابولیسم و تنفس میتواند به کاهش در مقابل تضعیف کارایی تولید کمک کند و لذا منتخبی از مطالعاتی را ارائه میدهیم که پاسخهای هموستاتیک مشاهده شده در میگوها را تشریح میکنند.
همانگونه که پیش از این ذکر شد، آمونیاک غیریونیزه شده به سرعت در غشاهای سلولی، از جمله در آبششها، پخش میشود و لذا زمانی که غلظتها در آب تولید افزایش مییابد، این امر منجر به افزایش قابل مقایسه در غلظت بافت درون میگوها میشود. میگوها معمولاً به افزایش آمونیاک در بافتها و همولنف خود از طریق کاهش نرخ تغذیه پاسخ میدهند که تصور میشود با کاهش تولید بافت و انباشت داخلی آمونیاک متابولیک کمک کند(باربری، 2010؛ کولت و آرمسترانگ، 1981؛ فرایز-اسپریکوتا و همکاران، 2000).
طبق گزارشها، مصرف اکسیژن به طرز معناداری در میگوهای سفید نوجوان در معرض غلظتهای TAN 2/14 میلی مول بر لیتر(معادل 0/07 میلی مول بر لیتر NH3-N در pH 7/8؛ تقریباً 7 میکرومول اکسیژن بر گرم بر ساعت) در مقایسه با 1/07 میلی مول(معادل 0/03 میلی مول بر لیتر NH3-N در pH 7/8؛ تقریباً 5/5 میکرومول اکسیژن بر گرم بر ساعت) پس از 24 ساعت بیشتر است(راکوتا و هرناندز-هرِرا، 2000).
آمونیاک میتواند تنش اکسیداتیو را نیز القا کند. مواجهه با 20 میلیگرم بر لیتر TAN (معادل 0/49 میلیگرم بر لیتر NH3-N در pH 7/9) در میگوی سفید منجر به آپوپتوز در هپاتوپانکراس علاوه بر کاهش فعالیت سوپراکسید دیسموتاز، بعنوان یک آنزیم آنتی اکسیدان، گردید(لیانگ و همکاران، 2016). سایر مطالعات نتیجه گرفتهاند که تنش آمونیاک (20 میلیگرم بر لیتر، معادل 0/28 میلیگرم بر لیتر NH3-N در pH 7/5) میتواند آمینواسید و متابولیسم نوکلئوتید و متابولیتهای لیپید در هموسیتها را مختل کند، که خود میتواند کارکرد هموسیت یا تعداد هموسیت با القای آپوپتوز در میگوی سفید را کاهش دهد(لیو و همکاران، 2020).
تولید
تحقیقات پیشین درخصوص اثرات ترکیبات نیتروژندار بر موفقیت تولیدمثل میگوی سفید نادر است. با این وجود، مطالعات درباره دیگر میگوی پنائیده، پنائوس پولنسیس[11]، نشان میدهند که مواجهه ترکیبی با 2/62 میلیگرم بر لیتر TAN(معادل 0/07 میلیگرم بر لیتر NH3-N در pH 7/77) و 1/50 میلیگرم بر لیتر NO2– هیچ تاثیر قابل اندازهگیری بر عملکرد تولیدمثل میگوی بالغ پس از یک مواجهه 46 روزه نداشتهاست(کاوالی و همکاران، 1989). در میگوی سفید، گزارش شدهاست که پتانسیل تولیدمثل بهینه در حدود 12 ماه برای هر دو جنس نر و ماده رخ میدهد، اما از آنجائی که این مطالعه تنها 46 روز طول کشید، آزمایشهای بلند مدت در طی سال اول عمر حیوان میتواند برای درک اثرات تولیدمثل مهم باشند(سبالوس- وازکز و همکاران، 2003، 2010).
اثرات تعاملی شوری و محصولات دفعی نیتروژندار
شوری یک عامل کلیدی در تعیین سمیت محصولات دفعی نیتروژندار برای میگوی سفید است. در اینجا ما به بررسی تحقیقات علمی برای اثبات اهمیت حفظ شوری در یک دامنه بهینه با توجه به سمیت آمونیاک/نیتریت/نیترات میپردازیم. نقطه ایزوسموتیک میگوی سفید(یعنی زمانی که اسمولالیته در مایعات داخلی بدن و محیط خارجی یکسان است) برابر با 25 psu گزارش شدهاست؛ بنابراین، این همان شوری است که باور گسترده برای بهینه بودن آن برای تنظیم اسمزی در این گونه وجود دارد(چانگ- روبلز و همکاران، 2014).
شوریهای بالاتر(بیش از 25 psu)، مقادیر LC50 را برای آمونیاک – نیتروژن در میگوهای نوجوان پستلاروی و نوجوان افزایش دادند، یعنی تحمل در برابر آمونیاک در شوریهای بالاتر بهبود مییابد(چن و لین، 2001؛ رستمی و همکاران، 2019). سطوح ایمنی پیشنهادی برابر با 2/44، 3/55 و 3/95 میلیگرم بر لیتر برای TAN و 0/12، 0/16 و 0/16 میلیگرم بر لیتر برای NH3-N(در pH 8/05) به ترتیب در 15، 25 و 35 psu تخمین زده شدند(چن و لین، 2001). در حمایت از این یافتهها، یک مطالعه جداگانه نشان داد که شوری کم تاثیری منفی بر تحمل TAN دارد و افزایشی نیز در مرگ و میر در 3 psu در مقایسه با 17 و 32 psu در زمان مواجهه میگوی سفید نوجوان با غلظتهای TAN 12 میلیگرم بر لیتر(معادل 1/53، 1/40 و 1/27 میلیگرم بر لیتر NH3-N در pH 8/30) و بالاتر وجود دارد(لی و همکاران، 2007). تاثیر شوری کمتر بر تحمل TAN در میگوی سفید نیز این روند را تایید میکند، جایی که LC50 48 ساعته از TAN برای میگوی نگهداری شده در 18 psu(42/6 میلیگرم بر لیتر، معادل 1/58 میلیگرم بر لیتر NH3-N در pH 7/8) در مقایسه با 10 psu(39/7 میلیگرم بر لیتر، معادل 1/56 میلیگرم بر لیتر NH3-N در pH 7/80) بالاتر بود(اسکولر و همکاران، 2010).
سمیت نیتریت در ارتباط با شوری محیط نیز با استفاده از روش آزمایشی مورد استفاده توسط چن و لین(2001) نیز بررسی شدهاست، اما با استفاده از نیتریت به جای آمونیاک. نتایج حاکی از آنند که شوری بالاتر(25 psu و بیشتر) مقادیر LC50 نیتریت – نیتروژن در میگوی سفید نوجوان را افزایش دادهاست، به این معنا که تحمل نیتریت تحت شوری بالاتر همانند تاثیر شوری بر سمیت آمونیاک بهبود مییابد(چن و لین، 2003). سطوح ایمن پیشنهادی نیتریت در 15، 25 و 35 psu به ترتیب 6/1، 15/2 و 25/7 میلیگرم بر لیتر نیتریت – نیتروژن تخمین زده شدند(چن و لین، 2003). یک مطالعه دیگر در نتیجهگیری خود محافظهکارانهتر عمل کرده و توصیه میکند که در شوریهای 8 و 24 psu، غلظتهای نیتریت(NO2– – N) به ترتیب کمتر از 2/5 و 10 میلیگرم بر لیتر باقی میمانند تا از آسیب به رشد و مرگ و میر جلوگیری شود(فورتادو و همکاران، 2016).
اثرات سمی ترکیبی آمونیاک و نیتریت را نیز باید مدنظر قرار داد. جالب اینکه اثرات همافزایی و متضاد نیتریت(NO2– – N) و TAN اثبات شدهاند که حاکی از عدم تاثیر مسنجم است(اسکولر و همکاران، 2010). در یک مثال، زمانی که سطوح نیتریت با کمترین غلظت تاثیر مشاهده شده[12](133 میلیگرم بر لیتر NO2– – N) تنظیم شدند، LC50 نیز(39/7 میلیگرم بر لیتر، معادل 1/56 میلیگرم بر لیتر NH3-N در pH 7/8) بدون نیتریت LOEC و 28/2 میلیگرم بر لیتر(معادل 1/1 میلیگرم بر لیتر NH3-N در pH 7/8 با نیتریت LOEC) کاهش یافت. این بدان معناست که نیتریت در LOEC تحمل TAN را در میگوی سفید کاهش دادهاست، و این ترکیب دارای تاثیر همافزایی بر بقاست، زیرا افزایش نیتریت ممکن است میگو را ضعیف کند. بالعکس، زمانی که TAN تا LOEC(30 میلیگرم بر لیتر) کاهش یافت، LC50 نیتریت افزایش یافت(154 میلیگرم بر لیتر بدون LOEC TAN و 187 میلیگرم بر لیتر با LOEC TAN) و لذا یک تاثیر متضاد بر جای میگذارد. منطق این یافتهها در این پژوهش بررسی نشد، و لذا در تفسیر یا کاربرد این یافتهها باید دقت کرد.
اثرات مرحله حیات بر سمیت آمونیاک
مورفولوژی، فیزیولوژی و توانایی میگو در تحمل استرس همگی در کل چرخه عمر تغییر میکنند. بیشتر تحقیقات علمی موجود و همچنین مطالعات ارائه شده در این فصل، از میگوی نوجوان استفاده میکنند؛ با این وجود، ما در اینجا چند نمونه از مراحل اولیه حیات ارائه میدهیم. برای مثال، در مرحله زوآ(2 تا 5 روز پس از هچینگ)، مرحله مایسیس(6 تا 9/5 روز پس از هچینگ) و پستلارو 1(11 تا 12 روز پس از هچینگ)، غلظتهای توصیه شده برای آمونیاک غیریونیزه ایمنی[13] به ترتیب 0/15، 0/26 و 0/19 میلیگرم بر لیتر(در pH 8/5) هستند(دی لوردس کوبوو همکاران، 2012). برای پستلارو 12(12 روز پس از پستلارو)، توصیه میشود که غلظت آمونیاک نیتروژن نباید از 1/22 میلیگرم بر لیتر(معادل 0/048 میلیگرم بر لیتر NH3-N در pH 7/92 فراتر برود) (فرایز- اسپریکوتا و همکاران، 2000).
نتیجهگیری
برای بهینه ساختن کارایی تولید، به حداقل رساندن تاثیر محصولات دفعی نیتروژندار در تمامی ابعاد فیزیولوژی میگو مهم است. تا به اینجا، سطوح ایمن محافظهکارانه آمونیاک، نیتریت و نیترات برای پرورش میگوی سفید برابر با 1/2(معادل 0/048 میلیگرم بر لیتر NH3-N در pH 7/92)، 2/5 و 177 میلیگرم بر لیتر تخمین زده شدهاند(فرایز- اسپریکوتا و همکاران، 2000؛ فورتادو و همکاران، 2014، 2016؛ هان و همکاران، 2017). همانگونه که بحث شد، سمیت این ترکیبات نیتروژندار بسته به تعداد عوامل دیگر که باید در زمان بهینهسازی تولید میگو از طریق مدیریت متغیر استخر مدنظر قرار بگیرند، تغییر میکند.
مدیریت کیفیت آب
مقدمه
پایش و کنترل موثر دما، شوری، اکسیژن محلول، pH، متغیرهای مرتبط با کلسیفیکاسیون و محصولات دفعی نیتروژن یکی از چالشهای کلیدی برای حصول اطمینان از بهرهوری و رشد پایدار در زمانی پرورش مونودون در سیستمهای مختلف تولید به شمار میرود. بنابراین، در این بخش، بررسی خواهیم کرد که چگونه سیستمهای مختلف تولید و پیشرفتهای تکنولوژیکی که به تازگی پدیدار شدهاند دچار تکامل گردیدهاند تا از این طریق درکی جامع از نحوه پایش، کنترل و مدیریت کیفیت آب در این سیستمها به دست آید.
اهمیت کیفیت آب در پرورش میگو
حفظ پارامترهای بهینه کیفیت آب در طی پرورش میگو برای اجتناب از تنش در طی دوره پرورش ضروری است. سطوح بالای تنش در میگوها بر رفتار تغذیه و رشد آنها تاثیر گذاشته، قابلیت ایمنی را کاهش داده و گسترش بیماری را تسهیل میبخشد. بنابراین، درک شرایط اکولوژیکی و محیطی درون مخازن/استخرهای میگو و نحوهی استخراج این پارامترها از شرایط بهینه به پرورشدهندگان کمک خواهد کرد تا شیوع بیماری بالقوه را پیشبینی کرده و زیانها را کاهش دهند(فریرا و همکاران، 2011).
برای تولید تجاری، حفظ پرورش تحت شرایط بهینه برای بیشینه ساختن عملکرد فیزیولوژیکی، بقا و بهرهوری میگوها ضروری است، و چنانچه در بخشهای پیشین بحث شد، خاص مراحل مختلف حیات است. در زیر اطلاعاتی را جمعبندی میکنیم که خواننده را قادر میسازد آستانههای ماکزیمم و مینیمم لازم برای حفظ بهرهوری بهینه را شناسایی کرده و در صورت نیاز به اقدامات اصلاحی آنها را شناسایی کند.
دما
همانگونه که به تفصیل در بخش 2 شرح داده شد، دما یک متغیر اساسی برای تولید پی.وانامی است(جدول 11.2 را بببینید) و چندین مطالعه نیز به ترسیم اثرات مستقیم دما بر رشد، عملکرد فیزیولوژیکی و بقای حیوانات پرداختهاست(مانند هی و همکاران، 2018؛ هوانگ و همکاران، 2017؛ ژانگ و همکاران، 2019).
میگوی پی.وانامی عمدتاً در استخرهای روباز در اقلیمهای گرمسیری و نیمه گرمسیری پرورش داده میشود که تغییرات دما در آنجا معمولاً حداقلی است(2 تا 3 درجه سانتیگراد). دما در این محیطها عمدتاً تحت کنترل دماهای هوای محیط و تابش نور خورشید است. در حالی که پی.وانامی در دامنههای دمایی 26 تا 30 درجه سانتیگراد تحمل کرده و عملکرد خوبی از خود نشان میدهد، اما تغییرات زمانی کوچک در دما ناشی از چرخههای روز شب، نوسانات دمای فصلی یا تغییرات محیطی ناگهانی مانند طوفان، میتوانند بر عملکرد تاثیر چشمگیری بگذارند. بنابراین، مکان استخر، طراحی و استراتژی مدیریت، ملاحظات اساسی در کاهش اثرات زیانآور نوسان دما بر بهرهوری میگو تا حد امکان به شمار میروند. برای مثال، در اقلیمهای نیمه گرمسیری، چرخههای تولید بصورت فصلی هماهنگ میشوند تا از ذخیرهسازی پستلارو در طی سردترین ماههای سال(اکتبر تا فوریه در نیمکره شمالی، آوریل تا آگوست در نیمکره جنوبی) جلوگیری شود.
جدول 11.2. سطوح بهینه توصیه شده برای دما، شوری و اکسیژن محلول برای پرورش پی.وانامی در مراحل مختلف حیات.
| متغیر | مرحله حیات | نقطه پایانی | واحد | منابع |
| دما | پستلارو، 0/02 گرم | تاثیر بر SGR | کمتر از 26 درجه سانتیگراد | پونس پالاکوس و همکاران، 1997
|
| دما | پی.وانامی | ترجیح دمائی | بیشتر از 31 درجه سانتیگراد | گونزالز و همکاران، 2010
|
| دما | پستلارو، PL16، میگوی نوجوان 10/9 گرم | LC50 کشنده | کمتر از 12/9 درجه سانتیگراد کمتر از 11/7 درجه سانتیگراد | پونتیها و همکاران، 2017 |
| دما | میگوی نوجوان 3/9 گرم، نابالغ، 10/8 گرم، بالغ 6 گرم | تاثیر بر SGR | کمتر از 28 درجه سانتیگراد بیشتر از 30 درجه سانتیگراد | ویبان و همکاران، 1995 |
| دما | پی.وانامی | حساسیت به WSSV | کمتر از 32/3 درجه سانتیگراد | ویدال و همکاران، 2001 |
| دما | پی.وانامی | حساسیت به وی.الجینولیتیکوس | بیشتر از 32 درجه سانتیگراد | چنگ و همکاران، 2005 |
| دما | بالغ نر، 48 گرم | کاهش تعداد اپسرم و ناهنجاریها | بیشتر از 26 درجه سانتیگراد، 36 psu | پرز ولاکوییز و همکاران، 2001 |
| شوری | پی.وانامی | نقطه ایزوسموتیک | 24/7 psu | کاستایل و لورنس، 1981 |
| شوری | پستلارو، 0/1 گرم | تاثیر بر SGR | کمتر از 3 psu | لارامور و همکاران، 2001 |
| شوری | پی.وانامی | تاثیر بر عملکرد و بقا | کمتر از 5 psu | دیاز و همکاران، 2001؛ لی و همکاران، 2007 |
| شوری | پستلارو، PL16، میگوی نابالغ 10/9 گرم | LC50 کشنده | کمتر از 1/80 psu کمتر از 2/40 psu | پونتیها و همکاران، 2017 |
| شوری | پی.وانامی | حساسیت به WSSV و وی.الجینولیتیکوس | کمتر از 15 psu | لین و همکاران، 2012 |
| شوری | میگوی نوجوان، 1/6 و 2/2 گرم | تاثیر بر SGR | بیشتر از 49 psu | بری و همکاران، 1994 |
| اکسیژن محلول | میگوی نوجوان، 6 و 8 گرم | تاثیر بر SGR | کمتر از 4 میلیگرم بر لیتر | نانواچای و همکاران، 2011 |
| اکسیژن محلول | میگوی نوجوان، 6 و 8 گرم | تاثیر بر بقا | کمتر از 2 میلیگرم بر لیتر | نانواچای و همکاران، 2011 |
| اکسیژن محلول | پی.وانامی | تاثیر بر کارکرد ایمنی | کمتر از 3 میلیگرم بر لیتر | فاون و همکاران، 2009 |
| اکسیژن محلول | لارو، PL6، میگوی نوجوان، 5 سانتیمتر، بالغ 11/5 سانتیمتر، ذخیره مولدین، 13/5 سانتیمتر | LC50 کشنده | 1/23 میلیگرم بر لیتر، 0/57 میلیگرم بر لیتر، 0/59 میلیگرم بر لیتر، 0/65 میلیگرم بر لیتر، | زو و همکاران، 2014 |
در عوض، پرورشدهندگان از این دوره غیرمزروعی برای انجام فعالیتهای مدیریت کلیدی برای بهسازی(مانند خشک کردن استخر) یا فعالیتهای آمادهسازی برای فصل بعدی رشد باز استفاده میکنند. کاربرد مزارع پرورش محصور برای تولید میگوهای نوجوان در شرایط کنترل دما به پرورشدهندگان اجازه میدهد که میگوهای بزرگتر را در استخرهای روباز ذخیره کنند، زمانی که دماهای محیطی بهینه هستند و همزمان با کاهش خطر تولید، به طرز قابل توجهی بازده افزایش مییابد.
شکل 11.3. سیستم پرورشی محصور در نیکاراگوئه.

در سیستمهای محصور(داخلی)، دما غالباً به وسیله طراحی واحد، و بخصوص، مولفههای سیستم که برای تنظیم دما(سایبان، عایق، گرمایش و سرمایش) انتخاب شدهاند تعیین میگردد(شکل 11.3). مزیت محیطهای داخلی این است که دما را میتوان حفظ کرد و لذا تولید در کل سال بهینه میشود. علاوه بر این، سیستمهای محصور امکان تولید در عرضهای جغرافیایی را فراهم میسازد که معمولاً برای پرورش میگو نامناسب تلقی میشوند(اقلیمهای بیرونی گرمسیری یا نیمه گرمسیری) و در آنجا پرورش در محیط آزاد امکانپذیر نیست. نکته اصلی در اینجا هزینه انرژی و تاثیر آن بر هزینههای تولید است. به بیان دقیق، هزینه انرژی به وسیله مصرف توان زیرساخت کنترل دما و اختلاف بین دمای آب منبع و دمای پرورش بهینه برای میگوها تعیین میشود.
اکسیژن محلول
غلظت اکسیژن محلول یکی از مهمترین عوامل استرس محیطی در پرورش میگو است. غلظت آن در آب استخر/مخزن نه تنها تحت تاثیر خودِ تنفس پی.وانامی، بلکه عوامل محیطی فراوانی مانند زیست توده جلبکی و بهرهوری(مانند شکوفهها یا مرگ)، بهرهوری فیتوپلانکتونها و ساختار میکروبی ماده آلی که شامل پسماند بیولوژیکی(مدفوع و لاشه) و غذای مصرف نشدهاست، قرار میگیرد. هرگونه انحراف در غلظت اکسیژن محلول تاثیر شدیدی بر بقا و عملکرد رشد(الان و ماگوایر، 1991؛ سیدمن و لورنس، 1985)، تنفس(پترسون و ثورن، 1995؛ وی و همکاران، 2002) و فشار اسمزی همولنف(چارمانتیر و همکاران، 1994؛ چنگ و همکاران، 2003) دارد و همچنین به بهبود حساسیت نسبت به پاتوژنها(چانگ و همکاران، 2002؛ لی مولاک و همکاران، 1998) و افزایش مرگ و میر در میگوها کمک میکند، همانگونه که در بخش 2 شرح داده شد.
در استخرهای محیط آزاد(بیرونی)، کم اکسیژنی(اکسیژن پایین) میتواند پیامدهای شدیدی برای ارگانیسمهای آبزی داشتهباشد و حتی منجر به مرگ شود(واکوئر-سانیر و دورت، 2008). این امر به طور خاص در استخرهایی ضروری است که فاقد ابزار اضافه هوادهی هستند و لذا در آنجا میگوها را میتوان در معرض کم اکسیژنی با احتمال کم جبران قرار داد(چانتال و همکاران، 2008). لایه کف استخرهای میگو که میگوها در آنجا بیشتر زمان خود را سپری میکنند، ممکن است حتی فاقد اکسیژن(اکسیژن صفر) در طی شب، به دلیل تنفس تمامی ارگانیسمها(میگوها، زئوپلانکتونها و جلبکها) و ترکیب میکروبی ماده آلی انباشته شده باشد(چنگ و همکاران، 2003).
پیشنهاد میشود که ظرفیت حمل بیولوژیکی یک استخر فاقد هوادهی تقریباً 0/15 کیلوگرم بر مترمربع یا 1500 کیلوگرم بر هکتار باشد. در استخرهای دارای هوادهی، که تولید اکسیژن صرفاً به بهرهوری اولیه(محدود به ساعات روز) یا افزودن منفعل اکسیژن از طریق انتشار از جو بستگی ندارد، ظرفیت حمل میتواند به طرز معناداری بالاتر باشد(تیدول، 2012). به طور کلی، فرض میشود که 1 اسب بخار هوادهی مکانیکی میتواند به 300 تا 500 کیلوگرم بر هکتار زیست توده مازاد تحت شرایط دما و شوری بهینه کمک کند.
زمانی که اکسیژن محلول به سطوح زیربهینه میرسد(جدول 11.2 را ببینید)، و بصورت گسترده کمتر از 3/0 میلیگرم بر لیتر پیشنهاد میشود، اقدام کاهشی ضروری است. استراتژیهای اتخاذ شده توسط پرورشدهندگان برای احیای سطوح بهینه DO در استخرهای محیط بیرون بر کاهش بار آلی محلول در آب تولید و یا جمع شده در کف استخر(میکروجلبکها، باکتریها، ریزهها، غذاهای خورده نشده و پسماندها) متمرکز هستند که عمدتاً از طریق تعویض بخشی از آب محقق میشود. در ضمن، پرورشدهندگان میتوانند تجهیزات مورد نیاز برای هوادهی مکانیکی به منظور کمک به گردش و هوادهی ستون آب، کاهش طبقهبندی یا حتی دستکاری عمق استخر برای برجسته کردن تاثیر باد بر سطح آب را نصب کرده یا کاربرد آنها را افزایش دهند(با این وجود، این استراتژی میتواند بر دمای استخر نیز تاثیر بگذارد).
در سیستمهای محصور(داخلی) که زیست توده میتواند به بیش از 10 کیلوگرم بر مترمربع(معادل بیش از 100 هزار کیلوگرم بر هکتار) برسد، حفظ غلظتهای اکسیژن محلول بالاتر از نقاط بهینه پیشنهادی برای این گونه و اغلب بالاتر از 5 میلیگرم بر لیتر، بصورت منظم اعمال میشود. چنین سطوحی از طریق بهبود استفاده از ابزار هوادهای(مانند دمندههای مولد) که در آنها هوا توسط لولههای PVC به مخازن و استخرها توزیع شده و به شکل حبابهای کوچک از طریق شیلنگهای ریزمتخلخل یا پخشکنندههای هوا وارد آب میشود، حفظ میشوند. استراتژیهای مازاد برای مقابله با دورههای اکسیژن محلول کم باید نرخ تغذیه را توجیه نمایند که در آنها فیدرهای خودکار به کار میروند و شامل برداشت غذای باقیمانده و جامدات تهنشین شده از طریق سیفون زدن، استفاده از کلاریفایرها، اسکیمرهای پروتئین یا فیلترهای سایکلون برای جامدات معلق، گربهماهی جزئی برای کاهش زیست توده میگو در نهایت تعویض آب هستند.
میزان هوا یا اکسیژن خالص لازم برای حفظ نورماکسی به نوع تولید و ظرفیت حمل سیستم تولید بستگی دارد. بعنوان یک قاعده سرانگشتی، تیدول(2012) معادله زیر را برای سیستمهای متکی به تثبیت TAN توسط باکتریهای هتروتروفیک و شورهساز پیشنهاد میدهد:
عبارت تولید برای اکسیژن[14]:
Poxygen = 0/25 کیلوگرم اکسیژن در هر کیلوگرم غذای مصرف شده توسط میگو
0/12 کیلوگرم اکسیژن در هر کیلوگرم غذای مصرف شده توسط شورهسازها
0/25 کیلوگرم اکسیژن در هر کیلوگرم غذای مصرف شده توسط هتروتروفها(تا 0/5/).
Poxygen کل = 0/5 کیلوگرم اکسیژن در هر کیلوگرم غذا برای سیستم
برخلاف افزودن اکسیژن به آب، به دلیل اینکه هر فرایند اکسیژن را از سیستم میگیرد عبارات تولید اکسیژن منفی هستند. اگر مدیریت جامدات مناسب نباشد، یک مقدار ایمن Poxygen نزدیک به 1 کیلوگرم اکسیژن در 1 کیلوگرم غذای اضافه شدهاست.
شکل 11.4. سیستم هوادهی مکانیکی اضطراری[15] در یک استخر نیمه متراکم، عربستان سعودی.

شوری
تغییرات در شوری محیطی بر عملکرد رشد و فیزیولوژی پی.وانامی تاثیرگذار هستند(لی و همکاران، 2007، 2008)، چنانچه به تفصیل در بخش 2 به آن پرداخته شد. میگوی پی.وانامی شوریپذیر است به این معنا که این میگو از توانایی تنظیم اسمزی در دامن وسیعی از شوریها برخوردار است(1 تا 50 psu؛ پانت، 1990). با این وجود، در شوری کم(زیر 5 psu)، عملکرد و بقای میگو کاملاً مهار شدهاست(دیاز و همکاران، 2001؛ لی و همکاران، 2007) و تحمل استرس پایین است(لی و همکاران، 2007، 2008؛ چن و لین، 2001، 2003) و گرفتگی عضلات، بی حالی و چرخش بی هدف در این گونه نمایان شدهاست(داویس و همکاران، 2002).
در استخرهای روباز(بیرونی)، شوری عمدتاً توسط فرایندهای طبیعی تبخیر و بارش باران کنترل میشود. به طور کلی، در استخرهای تولید، تبخیر سطح آب را تا 2 الی 10 میلی متر در روز(یعنی برداشت 20 تا 100 مترمربع بر هکتار در روز)، بسته به رطوبت و دمای فصلی کاهش میدهد(بوید و گروس، 2000؛ یو و بوید، 1994). استراتژیهای مورد استفاده برای حفظ شوری در دامنه بهینه(جدول 11.2 را ببینید) عمدتاً بر طراحی استخر متمرکز هستند تا امکان تعویض آب در صورت لزوم فراهم شود. اینها شامل تعویض آب سطحی پس از بارانهای سنگین، پمپاژ مکانیکی برای تنظیم شوری در طی جزر و مدهای کم/زیاد یا حتی حفظ سطح آب بالای عملیاتی برای اجتناب از کاهش چشمگیر در شوری پس از بارشهای سنگین هستند.
در سیستمهای بسته(داخلی)، تبخیر یک چالش عمده به شمار میرود. تبخیر در این سیستمها به دمای آب، فشار بخار آب(رطوبت) و شدت هوادهی بستگی دارد. به طور کلی، در سیستمهای دارای تعویض آب بسیار کم(کمتر از 1 درصد)، شوری تمایل دارد به سرعت تا سطوح بالاتر از مقادیر بهینه(بیش از 30 psu) افزایش یابد. در نتیجه، مقادیر بهینه را میتوان دوباره از طریق افزودن آب شیرین تعیین کرد. ساموکا و همکاران(2017) رویکرد زیر را برای بازیابی شوری در محدود مقادیر مطلوب پیشنهاد دادند:
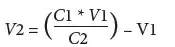
C1 = شوری فعلی(psu)
V1 = حجم آب(مترمکعب)
C2 = شوری هدف(psu)
V2 = حجم آب شیرین برای اضافه کردن(مترمکعب)
هر جا که شوری زیر سطوح بهینه یا هدف قرار میگیرد، افزودن نمکهای تجاری بصورت گسترده در پرورش میگوی تجاری به کار گرفته میشود. هر برند نمک دریای تجاری منجر به آب با ترکیب یونی، سطح مواد مغذی، pH و شوری متفاوت میشود. در نتیجه، پروفایل غذایی و شیمیایی هر برند باید از نقطه نظر مقادیر هدف برای آب تولید و در غذای میگو توجیه شود تا تعادل یونی لازم برای عملکرد و بقای بهینه حفظ شود.