مدیریت میکروبی: یک مفهوم کلیدی برای پرورش پایدار میگو

چکیده
در کنفرانس جهانی فائو با موضوع آبزیپروری در پوکت(تایلند) در سال 2010، فرض کردیم که آبزیپروری مدرن نیازمند یک نقطه عطف است(سورگلوس، 2013). اگرچه پرورش گیاهان و حیوانات آبزی به یک صنعت بالغ تبدیل شدهاست، اما بخش اعظم این فناوری کماکان به رویکردهای تجربی متکی است. توسعه دانش محور برای تبدیل آبزیپروری به یک فناوری زیستی آبی برای آینده مورد نیاز است. “مدیریت میکروبی بیشتر برای تولید پایدارتر” و “سیستمهای تولید یکپارچهتر برای پرورش گیاهان و حیوانات” بعنوان اولویتهای برتر این کنفرانس مطرح شدند.
ده سال بعد، میتوانیم پیشرفت معناداری را گزارش دهیم که عمدتاً مبتنی بر بینشهای نوین درخصوص نقش جمعیت میکروبی در آبزیپروری است. رویکردهای سنتی تحلیل پلیت کانت[1] و میکروسکوپ در آگاه ساختن ما از تعداد بالای باکتریهایی که ممکن است تداخل منفی در سیستمهای آبزیپروری داشتهباشند، نقشی ابزاری داشتهاند. با این وجود، نشان داده شدهاست که نه اعداد بلکه تنوع و کارکرد باکتریها در سیستمهای آبزیپروری باید بعنوان شاخصهایی برای دیسبیوزیس میکروبی مورد استفاده قرار بگیرند(وادستین و همکاران، 2018). این دیدگاه با کاربرد پلتفرمهای تحقیقات میکروبی نوآورانه مانند توالییابی نسل بعد و مدلهای حیوانی گنوتوبیوتیک ایجاد شد. یک نمونه از یافته مهم این بود که پاتوژنهای باکتریایی خاص در سیستمهای آبزیپروری میتوانند ویرولانس را بعنوان تابعی از تراکم جمعیت به وسیلهی مکانیسمهای کوئوروم سنسینگ[2] تنظیم کنند و به این ترتیب، بصورت جمعی عفونت را در ماهی یا میگو سازماندهی میکنند(دیفوردیت و همکاران، 2011). این مطلب نشان میدهد که چرا تشخیص پاتوژنها را نباید بعنوان پیشبین صرف عملکرد حیوانی دچار مخاطره تلقی کرد و اینکه چرا ما باید وضعیت کلی اجتماع باکتریایی را مدنظر قرار دهیم.
فقدان تجدیدپذیری و پیشبینیپذیری مشاهده شده در طی پرورش، علیرغم کنترل کامل سیستم کماکان یک مشکل ماندهاست. این امر بصورت خاص در سیستمهای پرورش لارو ماهیان دریایی پذیرفته شدهاست. در زمان اشاره به کنترل کامل، این امر شامل کنترل میکروبی نیست. در حقیقت، تا به امروز، ما از سیستمهای تولید خود بعنوان جعبههای سیاه بهرهبرداری کردهایم و تلاش کردهایم تا بیماریهای پاتوژنی را صرفاً با روشهای سرکوبگرانه تحت این فرض کلی کنترل کنیم که تنها حشره خوب یک حشره مرده است. با این وجود، براساس دیدگاههای میکروبی اخیر، معتقدیم که سرکوب به تنهایی بهترین رویکرد برای به حداقل رساندن خطر بیماری پاتوژنی نیست(دی اسکرایور و وادستین، 2014؛ وادستین و همکاران، 2018). یک کاهش غیرگزینشی باکتریهای ناخواسته به وسیله ضدعفونی برای به حداکثر رساندن امنیت زیستی باید همواره با بهبود گزینشی میکروبهای مطلوب همراه شود(وادستین و همکاران، 2018). تا به امروز، این امر منحصراً با استفاده از پروبیوتیکها انجام شدهاست. با این وجود، با دستکاری رقابت منابع در بین میکروبها، یعنی، تغییر قطعی عرضهی منابع نسبت تعداد باکتریها، جمعیتهای باکتریایی K استراتژیک را میتوان برای پیش گرفتن بر باکتریهای استراتژی r انتخاب کرد؛ باکتریهای استراتژی r، استراتژی اکولوژیکی بیشتر پاتوژنهای فرصتطلب هستند. این رویکرد بهبود 50 تا 100 درصدی را در چندین شاخص عملکردی نشان داد(وادستین و همکاران، 2018). مصرف پروبیوتیکها مکمل این رویکرد است، اما موفقیت پروبیوتیکها را زمانی میتوان به نحو چشمگیری افزایش داد که در شرایط سیستم حامی اکولوژی خود مورد استفاده قرار بگیرند. نتیجه، خطر اساساً کمتر بیماری در مقایسه با تنها یک رویکرد سرکوب/تخریب است.
هر دو مشاهده میدانی و آزمایشی که در طی ده سال گذشته جمعآوری شدهاند بر اهمیت رویکرد تشریح شده در بالا حمایت میکنند. یک نمونه، بهبود عملکرد مشاهده شده در سیستمهای گردشی با فیلترهای زیستی برای تولید پرورشی و تکثیر ماهیان دریایی و میگوهاست. حمایت از پرورش میگوهی متراکم در استخرهای بدون تعویض آب با توالتهای میگو برای افزایش برداشت پسماند، و از استخرهای استخراجی مملو از تیلاپیلا یا علف دریایی در حالت گردشی نشئت میگیرد. در چنین سیستمهایی، به نظر میرسد یک مکانیسم انتخاب میکروبی ذاتی وجود دارد که در مقابل چیرگی(تسلط) پاتوژنهای فرصتطلب مانند ویبریوها مقابله میکند. این امر منجر به خطر کمتر مداخله غیرقابل پیشبینی پاتوژنهای فرصتطلب با حفظ تراکم آنها زیر تراکم حسگری حدنصاب بحرانی میشود.
مشاهدات آزمایشی و تجربی موجود کنونی میتوانند مبنایی را برای یک آبزیپروری دانش محور و علم محور ایجاد کنند. استفاده از روشهای نوین، مانند فلوسیتومتری به همراه دستهبندی سلولی و توالییابی نسل بعد و نظریه علمی مناسب اساساً سطح درک ما را ارتقا داده و به آبزیپروری پایدارتر و پیشگویانهتر کمک کند.
مداخلهی منفی میکروبها در آبزیپروری
صنعتیشدن در آبزیپروری که منجر به دیسبیوزیس و بیماری میگردد
شیوهی اجرای امروزی آبزیپروری به هیچ قابل با تولید غیرقابل توجه 70 سال پیش قابل قیاس نیست. در دهههای 1950 و 1960، تولید آبزیپروری در نرخ حدود 5 درصد در سال رشد کرد و به حدود 8 درصد در سال در دهههای 1970 و 1980 رسید و از دهه 1990 نیز به میزان 10 درصد در سال رسیدهاست(فائو، 2000). این اعداد بیانگر انتقال و گذرا به سمت یک رویکرد صنعتی در تولید غذای آبزی هستند. صنعتی شدن صنعت آبزیپروری محرکی برای پیشرفتهای چشمگیر در دانش بیولوژیکی، بهبود در شرایط عملیاتی، تکامل در فناوری غذایی، و افزایش کاربرد فناوری زیستی بودهاست. با این وجود، صنعتی شدن با چالشهایی از نوع تولید صنعتی حیوان نیز همراهاست. صنعتی شدن نه تنها ممکن است تاثیر قابل توجهی بر محیط داشتهباشد بلکه ممکن است عملکرد آن را نیز دچار مخاطره کند. با توجه به محیط زیست، افزایش رخداد شیوع بیماریهای عفونی یکی از عوامل مداخلهگر در تولید آبزیپروری مدرن تلقی میشود. در طی کنفرانس GOAL در سال 2019 (چنای، هندوستان)، بیماریها بعنوان محدودیت جهانی شماره یک برای رشد صنعت آبزیپروری میگو شناخته شدند(شکل 8.1)، که همین امر برای سالهای 2017 و 2018 نیز رخ داد(به ترتیب در کنفرانسهای GOAL در دوبلین، ایرلند و گویاکوئیل، اکوادور).
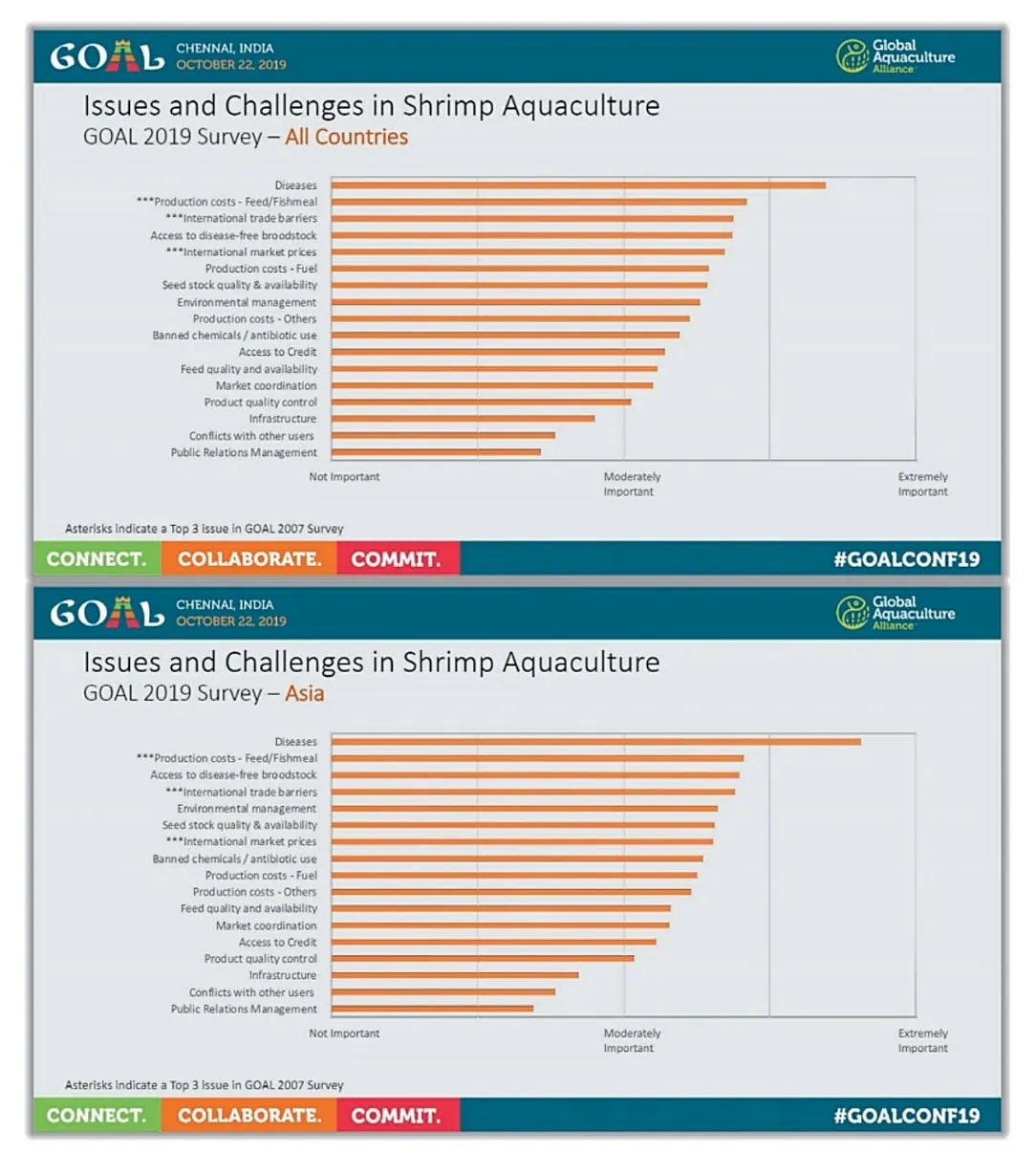 شکل 8.1. مسائل و چالشهای جهانی در آبزیپروری میگو که از پیمایشی جهانی برای کنفرانس GOAL 2019 شناسایی شدهاند.
شکل 8.1. مسائل و چالشهای جهانی در آبزیپروری میگو که از پیمایشی جهانی برای کنفرانس GOAL 2019 شناسایی شدهاند.
در زمان بررسی اپیزودهای بیماریهای عفونی که بخش آبزیپروری میگو در طی سالها به آنها پی بردهاست، نکته قابل توجه این است که فراوانی پیدایش بیماریها جدید اندکی پس از شروع تولید تجاری میگو افزایش یافت و سطوح میگوی تولیدی توسط این بخش نیز ارتقا یافت(شکل 8.2). همانند تولید حیوان در خشکی، افزایش خروجی تنها به این علت امکانپذیر است که سیستمها بیش از پیش بصورت صنعتی مورد بهرهبرداری قرار میگیرند و مشخصهی آنها خروجی بالاتر در هر واحد سطح یا حجم است(آلفورس، 2009). به بیان دیگر، تولید میگو در نواحی محدود در تراکمهای ذخیرهسازی بالاتر، با استفاده از توزیع ملی(بینالمللی) سویههای میگو، افزاش یکنواختی ژنتیک سویههای میگوی تولید شده، ورودیهای بیشتر(غذا و محصولات) در سیستمها و با سطوح بالاتری از تنش تجربه شده توسط حیوانات شروع شد. تمامی این عوامل در تکثیر پاتوژنها و افزایش خطر شیوع بیماریها دخیل هستند(کاتاسکای و همکاران، 2000).
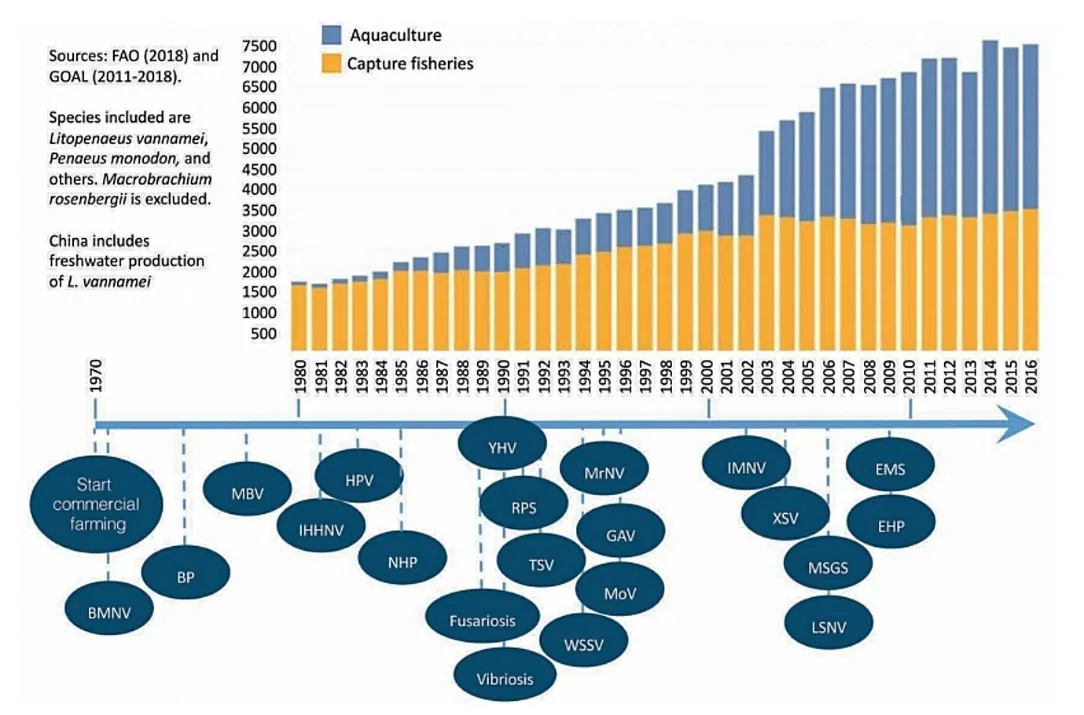 شکل 8.2. مروری کلی بر تولید جهانی میگو در انطباق با اپیزودهای شیوع بیماریهای جدید. BMNV: ویروس نکروز غده جنسی وسط روده باکولاویروس، BP: باکولوویروس پنائی، EHP: اینتروسیتوزون هپاتوپنایی، EMS: سندروم مرگ زودهنگام، GAV: ویروس مرتبط با آبشش، HPV: پارووویروس هپاتوپانکراس، IHHNV: ویروس نکروز هماتوپوئتیک و هیپودرمال عفونی، IMNV: ویروس مایونکروز عفونی، LSNV: ویروس لیم-سینگ، MBV: باکولوویروس نوع مونودون، MoV: ویروس موریلان، MrNV: نوداویروس ماکروبراکیوم روزنبرگی، MSGS: سندروم رشد آرام مونودون، NHP: هپاتوپانکراتیت نکروزکننده، RPS: رابدوویروس میگوی پنائیده، TSV: ویروس سندروم تورا، WSSV: ویروس سندروم لکه سفید، XSV: ویروس کوچک مازاد، YHV: ویروس سر زرد.
شکل 8.2. مروری کلی بر تولید جهانی میگو در انطباق با اپیزودهای شیوع بیماریهای جدید. BMNV: ویروس نکروز غده جنسی وسط روده باکولاویروس، BP: باکولوویروس پنائی، EHP: اینتروسیتوزون هپاتوپنایی، EMS: سندروم مرگ زودهنگام، GAV: ویروس مرتبط با آبشش، HPV: پارووویروس هپاتوپانکراس، IHHNV: ویروس نکروز هماتوپوئتیک و هیپودرمال عفونی، IMNV: ویروس مایونکروز عفونی، LSNV: ویروس لیم-سینگ، MBV: باکولوویروس نوع مونودون، MoV: ویروس موریلان، MrNV: نوداویروس ماکروبراکیوم روزنبرگی، MSGS: سندروم رشد آرام مونودون، NHP: هپاتوپانکراتیت نکروزکننده، RPS: رابدوویروس میگوی پنائیده، TSV: ویروس سندروم تورا، WSSV: ویروس سندروم لکه سفید، XSV: ویروس کوچک مازاد، YHV: ویروس سر زرد.
نیاز به درکی کلی از بیماری پاتوژنی در سیستمهای آبزیپروری
چندین نوع از میکروارگانیسمها وجود دارند که میتوانند باعث بیماری ویرانگری در طی پرورش میگو، هم در سطح لارو و هم سطح در حال رشد، شوند. چنین پاتوژنهایی شامل ویروسها، قارچها، انگلها و باکتریها هستند(کاروناساگار و همکاران، 2014). تاریخچهی پرورش میگو شامل تعداد بالای اپیزودهای بیماری است، چنانچه در شکل 8.2 شرح داده شدهاست. در هر اپیزود، تلاشهایی برای شناسایی عامل سببی در اسرع وقت بعنوان نقطه عطفی برای توسعه استراتژیهای پیشگیرانه یا درمانی خاص صورت گرفتهاست. پس، چنین استراتژیهای ترجیحاً شامل رویکردهای پیشگیرانه برای اجتناب از وقوع بیماری هستند. نمونههایی از چنین استراتژیهایی شامل گنجاندن پاتوژنها در فهرست برای تولید میگوی عاری از پاتوژن خاص[3]، توسعه باکتریوفاژهای گزینشی(کودهاری و همکاران، 2017) یا فناوریهای جدیدتر در حال توسعه مانند درمان میگو باRNA مداخلهای بسیار خاص[4] هستند. رویکردهای درمانی در مقابل بیماریهای ویروسی و انگلی تقریباً وجود خارجی ندارند(پینتو و سیبرت، 2012)، در حالی که وقوع بیماریهای باکتریایی یا قارچی اغلب اوقات با استفاده از مواد شیمیایی درمان شدهاست و آنتیبیوتیکها بعنوان بدنامترین نمونه شناخته شدهاند. مورد آخر رویکردی است که باید در اسرع وقت آن را رها کرد، چنانچه بیش از گذشته در صنعت و محیط علمی مورد پذیرش واقع میشود(روماس و سانتوس، 2018).
در مواردی که امکان یافتن یک روش خاص(پیشگیرانه یا درمانی) برای کنترل یک بیماری وجود ندارد، بهترین رویکرد یک رویکرد کلنگرانه است. این رویکرد به معنای تلاش برای بیشینه ساختن قدرت میگوی پرورشی با تامین رژیمهای غذایی باکیفیت بالا، تحریک ایمنی، و انتخاب ژنتیک، است، در حالی که همزمان در تلاش برای کمینه ساختن تنش و فشار بیماری است(شکل 8.3).
برای سالها، پاتوژنهای اجباری این صنعت را در تعداد و شدت بالا دچار مشکل کردهاست. بنابراین، این پاتوژنها در توسعه استراتژیهای کنترل بیماری بسیار مورد توجه واقع شدهاند. این تمرکز بر پاتوژنهای اجباری در بررسیهایی تشریح شدهاست که درخصوص بیماری پاتوژنی در پرورش میگوها منتشر شدهاند(مانند تیتامادی و همکاران، 2016). یافتن راهکارهای عملی در اصل، حذف مخرب پاتوژن اجباری از سیستم است. این رویکرد ریشهکنسازی هنوز به نحوی اساسی در رویههای مدرن پرورش میگو نقشی کلیدی دارد، برای مثال زمانی که به طور پایدار به شکل ضدعفونیسازی برای پاکسازی محیط به کار میرود و آب قبل از میگو وارد محیط میشود. در حقیقت، امنیت زیستی خطر شیوع بیماریهای ناشی از تعداد بالای پاتوژنهای اجباری را کاهش میدهد. متاسفانه، حفاظت کاملی در مقابل انواع پاتوژنها فراهم نمیسازد، حتی زمانی که به اندازه کافی به کار گرفته میشود. در مورد برخی پاتوژنها، عمدتاً پاتوژنهای فرصتطلب، کاربرد اقدامات امنیت زیستی به تنهایی کمینه ساختن خطر بیماری را چالشبرانگیزتر میکند. این امر به اکولوژی آنها ارتباط دارد که از اکولوژی پاتوژنهای اجباری متفاوت است. در بخش “پایداری میکروبی بعنوان مفهوم اساسی در مدیریت میکروبی پایدار” در این همین فصل، دلایل این امر را با جزئیات شرح خواهیم داد. یک مثال، بیماری نکروز هپاتوپانکراس است که توسط عوامل باکتریایی از جنس ویبریو رخ میدهد(دی اسکرایور و همکاران، 2014). علیرغم به کارگیری اقدامات کافی امنیت زیستی، پرورشدهندگان کماکان با این بیماری مواجه هستند. امروزه میدانیم که AHPND به وسیله طیفی از ویبریوها رخ میدهد(زیائو و همکاران، 2017) که باکتریهایی به شمار میروند که میتوانند مستقل از میزبان در محیط زنده بمانند و نمونههایی عادی از پاتوژنهای فرصتطلب هستند. بنابراین، علیرغم ایجاد یک بیماری با علائم بالینی بسیار ویژه، اکولوژی این پاتوژنها کاملاً متفاوت از اکولوژی پاتوژنهای اجباری است که نیازمند یک میزبان برای بقا هستند. بنابراین، ملاحظات بیشتری برای کنترل پاتوژنهای فرصتطلب مورد نیاز است.
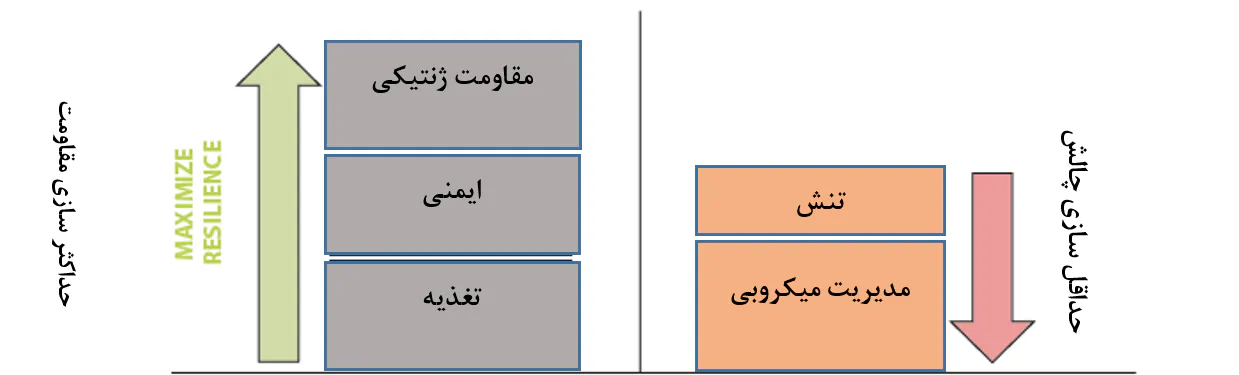 شکل 8.3. رویکردی کلنگرانه برای کمینه ساختن تاثیر بیماریهای پاتوژنی در پرورش میگو. این مفهوم شامل حمایت از مقاومت حیوانات در مقابل مداخله پاتوژنی از طریق تامین تغذیه بهینه، تحریک سیستم ایمین و مقاومتر کردن آنها به لحاظ ذاتی است. در عین حال، به حداقل رساندن سطح استرس حیوانات و سطح فشار پاتوژنی که درون سیستم تجریه میکنند نیز حائز اهمیت است. همانگونه که رویکرد کنونی استفاده از مواد شیمیایی برای مبارزه با پاتوژنها ناپایدار و اغلب غیرموثر بودهاست، اما موضوع آخر جایی است که رویکردهای جدید برای مدیریت میکروبی باید به آن وارد شوند. این امر مستلزم درکی کامل از دینامیک و قابلیت عملکرد جمعیت میکروبی است که در سیستمهای آبزیپروری میگو توسعه مییابد.
شکل 8.3. رویکردی کلنگرانه برای کمینه ساختن تاثیر بیماریهای پاتوژنی در پرورش میگو. این مفهوم شامل حمایت از مقاومت حیوانات در مقابل مداخله پاتوژنی از طریق تامین تغذیه بهینه، تحریک سیستم ایمین و مقاومتر کردن آنها به لحاظ ذاتی است. در عین حال، به حداقل رساندن سطح استرس حیوانات و سطح فشار پاتوژنی که درون سیستم تجریه میکنند نیز حائز اهمیت است. همانگونه که رویکرد کنونی استفاده از مواد شیمیایی برای مبارزه با پاتوژنها ناپایدار و اغلب غیرموثر بودهاست، اما موضوع آخر جایی است که رویکردهای جدید برای مدیریت میکروبی باید به آن وارد شوند. این امر مستلزم درکی کامل از دینامیک و قابلیت عملکرد جمعیت میکروبی است که در سیستمهای آبزیپروری میگو توسعه مییابد.
عوامل سببی AHPND به گروه مشابهی از باکتریها که مسئول شیوع ویبریوز لومینوسنت در اوایل دهه 1900 بودند تعلق دارد. این بیماری توسط ویبریو هاروی و گونههای دارای ارتباط نزدیک با آن ایجاد میشود که همگی به کلاد هاروی ویبریوز تعلق دارند(دیفوردت و همکاران، 2007). همانند AHPND، ویبریوز لومینوسنت در طی 10 تا 45 روز اول پس از ذخیرهسازی پستلارو میگو در استخرهای رشد باز رخ داد. قبل از شیوع این بیماری، افزایش قابل توجهی در تعداد ویبریوهای فرصتطلب در آب استخر مشاهده شد(لاویلا- پیتوگو و همکاران، 1998). این افزایش پس از ضدعفونیسازی استخر رخ داد(براتوولد و همکاران، 1999؛ لاویلا- پیتوگو و همکاران، 1998)، اما در آن زمان هیچ پیوند مهمی وجود نداشت.
در همین دسته از پاتوژنها، میتوان پاتوژنهایی را گنجاند که به احتمال زیاد مسئول تاثیرگذاری منفی بر اولین مراحل عمر ماهیان و میگوها هستند. وادستین و همکاران(2018) شرح دادند که برای ماهیان دریایی، بسته به گونهها و فناوری پرورش برای گونههای مشخص، معمولاً بقا 3 تا 10 درصد در دگردیسی در مرحله آغازین اهلیسازی است. با این وجود، هیچ دلیلی وجود ندارد که چرا بیشتر تخمهای(بیش از 80 درصد) تولید شده از یک ذخیره مولدین پرورشیافته میمیرند، و بنابراین این ادعا مطرح شد که بقای حدود 50 درصد یا کمتر، شاخصی از شرایط زیربهینه پرورش است. از دامنهای از مطالعات انجام شده توسط وادستین و همکارانش درخصوص جوانترین مراحل عمر ماهیان دریایی، مشخص شد که تعاملات زیانآور ماهی – میکروب یک عامل کلیدی هستند که منجر به عملکرد ضعیف و تجدیدپذیری و پیشبینیپذیری کم در طی تغذیه اولیهی لاروهای دریایی میشوند و به ندرت این امکان وجود دارد که پاتوژنهای خاصی که علت این مسائل هستند، شناسایی شوند. دلیل اصلی این است که مشکلات مشاهده شده به واسطه پاتوژنهای واقعی رخ نمیدهند، بلکه در عوض دیسبیوزیس جمعیت میکروبی نرمال هستند. این امر ممکن است شامل باکتریهای فرصتطلبی باشد که در یک حیوان تحت استرس و نابالغ به لحاظ فیزیولوژیکی تجمع میکنند و مستقیماً منجر به بروز بیماری میشوند یا از طریق یک عفونت ثانویه عمل میکنند. همین گروه از محققان دریافتند که به طور خاص زمانی که روشهای ریشهکنسازی غیرگزینشی بدون کنترل کلونیسازی بعدی به کار گرفته میشوند، به نظر میرسد که انتخابی برای گونههای باکتریایی فرصتطلب وجود داشتهباشد. یک نمونه کاربردی از تاثیر چنین مداخله میکروبی به ظاهر تصادفی منجر به عدم پیشبینیپذیری در بقا در طی پرورش ماهیان دریایی در شکل 8.4 ارائه شدهاست.
برای اولین مراحل عمر میگوها، ادعاهای مشابه از رویدادهای زیان تصادفی ظاهری مرتبط با دیسبیوزیس میکروبی مطرح شدهاست(زنگ و همکاران، 2017). یک نمونه شناخته شده، سندروم zoea-2 است که در آن، لارو اطراف مرحله zoea 2 به طرز رمزآلودی شروع به نمایش مرگ و میر سنگین بدون هیچگونه دلیل آشکار میکند. تا به امروز، هیچ عامل عفونی خاص شناسایی نشدهاست، اما پیشنهاد شدهاست که مداخله میکروبی منفی و به احتمال زیاد پاتوژنهای فرصتطلب نوع ویبریو، ممکن است علت آن باشند(کومار و همکاران، 2017). یک موقعیت مشابه برای سندروم بولیتاس[5] وجود دارد که در لاروهای میگو در آمریکای لاتین مشاهده شدهاست و بصورت قسمتی از سلولهای اپیتلیال در روده و هپاتوپانکراس مشاهده میشود و به دنبال آن، کرههای کوچک درون روده شکل میگیرد. یک علت باکتریایی برای این سندروم تشریح شدهاست و تحقیق وادنبرگ و همکاران(1999) بیانگر نقش گونههای مختلف ویبریو است. علاوه بر این، مسئله ویبریوز لومینوسنت در مراکز تکثیر میگو امروز نیز وجود دارد(سوتومایور و همکاران، 2019). علیرغم اینکه به نظر میرسد عامل این بیماری پاتوژنهای فرصتطلب جنس ویبریو باشند، اما کماکان بعنوان مسئلهای با پیشبینیپذیری پایین و تاثیر بالا مطرح است.
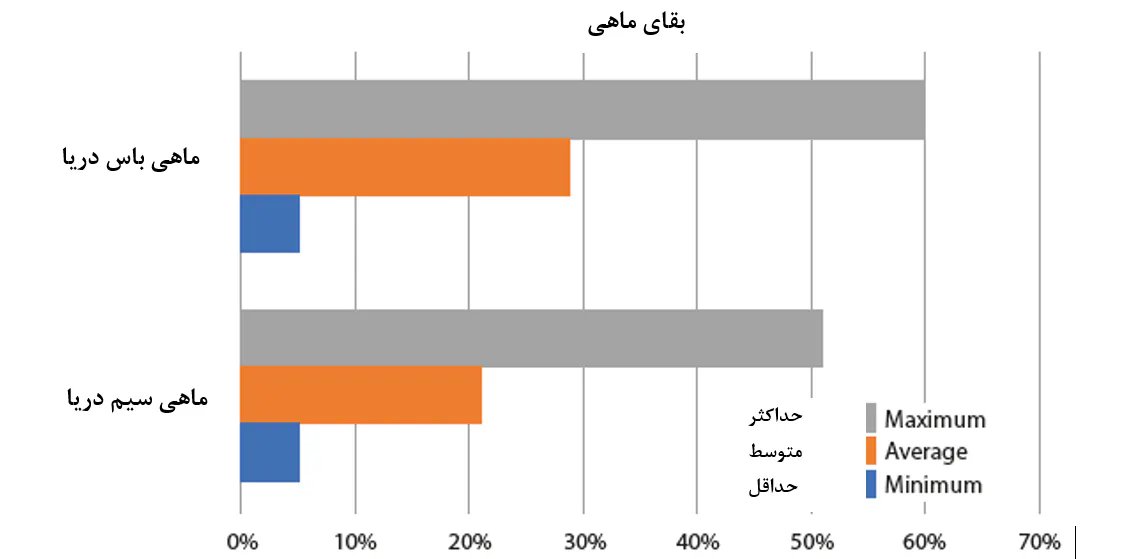 شکل 8.4. دادههای سال 2019 بیانگر تغییر در عملکرد لاروی هستند که در مرحله تکثیر پرورش ماهیان دریایی مشاهده میشود، در این مورد بقای تکثیر ماهی باس و ماهی سیم در دریای مدیترانه. اطلاعات علمی بیانگر آن است که مداخله میکروبی منفی تصادفی توسط پاتوژنهای فرصتطلب علت احتمالی برای بخش بزرگی از این تغییر است.
شکل 8.4. دادههای سال 2019 بیانگر تغییر در عملکرد لاروی هستند که در مرحله تکثیر پرورش ماهیان دریایی مشاهده میشود، در این مورد بقای تکثیر ماهی باس و ماهی سیم در دریای مدیترانه. اطلاعات علمی بیانگر آن است که مداخله میکروبی منفی تصادفی توسط پاتوژنهای فرصتطلب علت احتمالی برای بخش بزرگی از این تغییر است.
دید تونلی فعلی در مدیریت میکروبی برای آبزیپروری
علیرغم این واقعیت که پرورشدهندگان از وجود میکروارگانیسمهای فرصتطلب مضر در سیستمهای پرورش خود آگاه هستند، اما ما کماکان با سختیهایی در کنترل و مبارزه با این میکروبها مواجه هستیم. برای مدت زمانی طولانی، تمرکز اریب بر پارامترهای فیزیکی و شیمیایی(دما، pH، اکسیژن محلول، آمونیاک، نیتریت، نیترات، قلیائیت، …) این احساس را ایجاد میکرد که تمامی متغیرهای احتمالی در طی پرورش تحت کنترل بودهاند. رویههایی مانند استفاده مجزا از مخازن یا استخرها، مصرف آب و ضدعفونیسازی مخزن/استخر، استفاده از تجهیزاتی که نمیتوان به طور مشترک بین واحدهای مختلف پرورش مورد استفاده قرار داد، و ضدعفونیسازی دستها و چکمههای کارگران زمانی معرفی شدند که مشخص شد ما مداخله میکروبی را کنترل نکردهایم. اگرچه این روشهای کنترل میکروبی برای حفظ و به کارگیری بسیار مهم هستند، اما تاحدودی موثر واقع میشوند، چنانچه این واقعیت دال بر شواهدی از آنهاست که بیماری عفونی ناشی از پاتوژنهای فرصتطلب هنوز یک مشکل بزرگ است. این بدان علت است که هنوز آگاهی ناکافی نسبت به اهمیت ترکیب میکروبی، دینامیک و قابلیت عملکرد در طی پرورش میگو به چشم میخورد. در نتیجه، ما هنوز میگوها را در جعبههای سیاه میکروبی پرورش میدهیم. بنابراین، با اطمینان میتوان این فرضیه را مطرح کرد که عملکرد غیرقابل پیشبینی به دلیل ترکیب میکروبی غیرقابل کنترل و فعالیت در سیستمهای پرورش است.
از مباحث پانل نخبگان درخصوص “بهبود امنیت زیستی: ضرورتی برای پایداری آبزیپروری” در طی کنفرانس جهانی آبزیپروری 2010 (FAO/NACA، 2012)، چند جمله را میتوان نقل کرد که بازتابی از وضعیت آگاهی نسبت به جمعیت میکروبی باکتریایی و مدیریت آن در رویههای پرورش میگو هستند:
«از طریق مقایسه با پاتوژنهای ویروسی، کار بر روی کنترل پاتوژنهای میگو شدت کمتری داشتهاست و عمدتاً بر رویههای مدیریت پرورش در ارتباط با کنترل محیط در مخازن تکثیر و استخرهای پرورش متمرکز بودهاست. بیشتر این کارها بر مصرف پروبیوتیکها و محرکهای زیستی متمرکز بودهاست.»
با پرداختن به کاربرد فناوریهای جدید مانند پروبیوتیکها، محرکهای ایمین و واکسنها، تغییر اندکی در وضعیت از سال 2005 رخ دادهاست. علیرغم کاربرد وسیع پروبیوتیکها و تا حدودی کمتر، محرکهای ایمنی در پرورش میگو، هیچگونه نتایجی از آزمایشهای میدانی مقیاس بزرگ برای اثبات این مطلب از طریق آنالیز آماری وجود ندارد که آنها در حقیقت موثر واقع شدهاند. آزمایشهای میدانی و تحقیقات بیشتری برای کنترل کوئوروم سنسینگ پاتوژنهای باکتریایی مورد نیاز است.
علیرغم فقدان دانش عمقی درخصوص ترکیب میکروبی و دینامیک، پرورشدهندگان از ابزار مداخله میکروبی در جهت دستیابی به کنترل جمعیت میکروبی مداخلهآمیز در طی پرورش میگو استفاده کردهاند. همانگونه که توسط بسیاری از مطالعات در این حوزه تشریح شدهاست(مانند دَش و همکاران، 2017؛ حسینیفر و همکاران، 2018؛ جمال و همکاران، 2019؛ نیوانا و سلوین، 2009؛راماچاندران، 2017؛ سلطانی و همکاران، 2019؛ ونهای و فوتدار، 2010)، در حال حاضر یک دیدگاه تونلی وجود دارد که ضدعفونی کردن و پروبیوتیک را بعنوان ابزار مدیریت میکروبی برای این صنعت مدنظر قرار میدهد. پروبیوتیکها توسط گیت سوپ (1991) وارد رویههای آبزیپروری شدند و از آن زمان، محبوبیت فراوانی یافتهاند. اثرات سودمندی که به کاربرد پروبیوتیکها نسبت داده شدهاند عبارتند از(1) کنترل پاتوژنها از طریق تولید ترکیبات ضدمیکروبی و رقابت برای مواد مغذی و نقاط چسبندگی، (2) ارتقای سلامت حیوان از طریق القای پاسخهای ایمنی و کمک به هضم و مکمل مواد درشتمغذیها و ریزمغذیها و(3) بهبود کیفیت محیط(بالکازار و همکاران، 2006؛ گیت سوپ، 1999؛ اوستین و ایرینتو، 2002؛ ورسچور و همکاران، 2000). مقالات متعددی درخصوص کاربرد پروبیوتیکها در پرورش میگو وجود دارد(مانند دش و همکاران، 2017؛ حسینیفر و همکاران، 2018؛ جمال و همکاران، 2019؛سیلوا ونیناو، 2009؛ راماچاندران، 2017؛ سلطانی و همکاران، 2019؛ فوتدار و ون های، 2010). لازم به ذکر است که تقریباً تمامی مطالعات گزارش میدهند که چگونه کاربرد پروبیوتیکها میتواند به بهبود کلی در عملکرد حیوانات از نقطه نظر رشد و یا افزایش بقا کمک کند، خواه تحت شرایط یک چالش پاتوژنی باشند یا نباشند. علاوه بر این، این بازخورد شفاف از مشاهده میدانی وجود دارد که کاربرد پروبیوتیکها میتواند منجر به مزایای آشکاری از نقطه نظر شرایط پرورش محیطی یا عملکرد میگو شود. تمامی این مطالب حاکی از آنند که کاربرد پروبیوتیکها ممکن است در حقیقت به کاهش خطر بیماریهای پاتوژنی کمک کند. با این وجود، گفتن این مطلب نادرست است که کاربرد پروبیوتیکها، پاسخی به این سوال است که چگونه بیماری پاتوژنی در پرورش میگو کنترل میشود(خواه ناشی از پاتوژنهای خاص یا پاتوژنهای فرصتطلب باشد). نمونههای همارزی وجود دارد، هم از محیط آکادمیک و هم از صنعت، که در آنها کاربرد پروبیوتیکها مانع بیماری نشد. بنابراین، در حالی که پتانسیل ذاتی در کاربرد آنها وجود داد، اما کماکان پیشرفت زیادی بایستی رقم بخورد. تولید دانش درخصوص نحوه عملکرد واقعی پروبیوتیکها در محیط کشت و نحوهی تعامل آنها با جمعیت میکروبی در سیستمهای آبزی برای داشتن انتظارات واقعبینانه از فعالیت آنها و همچنین درک این امر ضروری است که مدیریت میکروبی نیازمند چیزی فراتر از کاربرد پروبیوتیکها است.
اکثر مطالعاتی که در طی سالهای گذشته درخصوص کاربرد پروبیوتیکها در پرورش میگو انجام شدهاست، درخصوص عملکرد پرورش میگوهای درمان شده با پروبیوتیک(مانند رشد، بقا، نسبت تبدیل غذا، تحمل تنش) گزارشهایی ارائه میدهند. برخی مطالعات نیز شامل تحلیلهایی همچون متغیرهای ایمنی(مانند تعداد کل هموسیت، انفجار تنفسی، فعالیت بیگانهخواری، بیان ژن)، فعالیت آنزیمها(مانند سوپراکسید دیسموتاز، کاتالاز، فنل اکسیداز) یا شمارش باکتریایی(مانند شمارش هتروتروفیک کل، شمارش فرضی ویبریو) هستند. با این وجود، تقریباً تمامی مطالعات در نشان دادن طریقهی عملکرد درون کشتی واقعی(یا به بیان دیگر، علیت) پروبیوتیکها و به دنبال آن نحوه و چرایی عملکرد آنها، عدم فعالیت آنها، در همان مورد خاص، ناموفق بودهاند. بنابراین، علیرغم ورود به صنعت در حدود 30 سال پیش، پروبیوتیکها هنوز عمدتاً به شیوهای کلی مورد استفاده قرار میگیرند. با این وجود، تجربه عملی نشان میدهد که مقابله با چالشهای بیماری پاتوژنی پیش روی صنعت کافی نیست. گرووِر و همکاران(2012) اظهار داشتند که حتی برای کاربرد در انسانها، که به لحاظ علمی حوزهای پیشرفتهتر از آبزیپروری است، اثبات ادعای سلامت در ارتباط با پروبیوتیکها کماکان ضروری است. این امر تنها زمانی محتمل خواهد بود که بتوانیم از درک بهتری نسبت به ترکیب، پویایی و قابلیت عملکرد میکروارگانیسمهای باکتریایی در سیستم تحت بررسی شروع کنیم. این دانش پایه درخصوص باکتریهای خوب و بد نشان میدهد که اصلاحاتی که بایستی اعمال کنیم(مثلاً با استفاده از پروبیوتیکها) تا فعالیت میکروبها بهبود یافته و نقش آنها در عملکرد سیستم به حداکثر برسد کدامند. با در نظر گرفتن تمایز در کل مراحل توسعهای میگو، کاربرد پروبیوتیکها میتواند موفقتر باشد(زوئینگ و همکاران، 2016).
پلتفرمهای تحقیقاتی نوآورانه، دیدگاههایی درخصوص ترکیب و قابلیت عملکرد اجتماع میکروبی خلق میکنند
مدلهای تحقیقاتی گنوتوبیوتیک
نتیجهگیری دیگر از کنفرانس جهانی آبزیپروری 2021 (FAO/NACA، 2012) این بود که «کار بر روی اکولوژی مولکولی(یعنی متاژنومیک) و مهندسی بیوشیمیایی برای کنترل پویایی میکروبی در استخرهای میگو و مخازن تکثیر نسبتاً نادیده گرفته شدهاست.»
برای یک دوره زمانی طولانی، ما به روشهای مبتنی بر پرورش برای ارائه دیدگاهی درخصوص وجود میکروارگانیسمهای مداخلهگر در سیستمهای پرورش میگو متکی بودیم(مانند زنگ و همکاران، 2016). به دلیل سوءگیری پرورش، چنین مطالعاتی تنها بخشی از اطلاعات مورد نیاز برای ارزیابی نحوهی مداخله میکروبها در عملکرد میگو را آشکار میسازند. خوشبختانه، در طی 20 سال گذشته، روشهای موجود پیشرفت عظیمی را پشت سر گذاشتهاند که تا به امروز عمدتاً برای افزایش احتمالات برای تشخیص پاتوژنها به کار گرفته شدهاند(شکل 8.5). اما، همانگونه که مدیریت میکروبی نیازمند چیزی فراتر از تشخیص پاتوژن است، پلتفرمهای تحقیقاتی بیشتر و بیشتری برای تعیین قابلیت کارکرد میکروارگانیسمهای باکتریایی، هم پاتوژنها و هم عوامل مشترک، که در اطراف حیوانات پرورش یافته توسط ما زندگی میکنند، به کار برده میشوند.
| پیشرفتهای تکنولوژیکی و تکامل در روشهای تشخیص پاتوژن در آبزیپروری میگو | |||
| سنجش زیستی، پرورش پاتوژن و هیستوپاتولوژی | سنجش ایمنی(ELISA) دهه 1980 | PCR و qPCR دهههای 1990 و 2000 | تشخیص سمت استخر |
| · سنجش زیستی: چالش پاتوژن حیوانات سالم و مشاهده علائم بالینی/هیستوپاتولوژی/کشت پاتوژن درون کشت(مانند کلونیهای باکتری در پلیت) · نتایج: چند روز تا چند هفته · سطح تشخیص: کل ارگانیسمها/سلولها · ذهنی: نتایج نیازمند تفسیر هستند · بسیار کاربر/دستی | · هدف: آنتی ژن بر روی سطح پاتوژن(مانند پروتئین کپسید ویروسی) · نتایج: تقریباً دو روز · سطح تشخیص: 1 میلیون سلول · ارزان و ساده · مسائل ویژگی: مثبتهای کاذب/منفیهای کاذب · تاحدودی خودکار | · هدف: DNA/RNA (یک کپی از پاتوژن) · نتایج: چند ساعت تا چند روز · سطح تشخیص: 1000 سلول · پرهزینه، مستلزم ابزاردقیق و کارکنان دارای مهارت فنی است · خودکارسازی کامل/جزئی | · هدف: پروتئین/DNA/RNA · نتایج: چند ساعت · سطح تشخیص: 100 سلول · دقت برتر صرف نظر از هدف · کاملاً خودکار است و امکان قابلیت ردیابی را فراهم میسازد
¯ تشخیص نسل بعد
|
| تشخیص مبتنی بر آزمایشگاه | تشخیص نقطه مراقبت | ||
شکل 8.5. روند تکامل در پیشرفتهای تکنولوژیکی برای تشخیص پاتوژن میگو که توسط پروفسور ارون دهار در کنفرانس 2019 آبزیپروری آسیا اقیانوسیه در چنای(هندوستان) ارائه گردید. تشخیص پاتوژنهای میگو در طی پرورش امروزه یک متغیر مهم برای ارزیابی خطر بیماری به شمار میرود. با این وجود، یک سوال برای پرسیدن این است که آیا تشخیص یک پاتوژن، مطمئنترین عامل پیشبینی کننده برای شیوع بیماری تصور میشود و لذا باید آن را بعنوان یک ابزار تصمیم به کار برد یا خیر. همانگونه که پژوهش زوئینگ و همکاران(2017) نشان دادهاست، تغییرات در رد میکروبی روده زودتر از پیدایش علائم بیماری رخ میدهد و لذا ممکن است بعنوان هشدار اولیه بیماری برای نسل بعد در طی پرورش میگو مورد استفاده قرار بگیرد.
برای مثال، استفاده از مدلهای حیوانی گنوتوبیوتیک بعنوان یک مدل پژوهشی موضوع جدیدی نیست(مارکوس و همکاران، 2005)، اما بیش از پیش با رویکردهای نوآورانه مانند ژنومیک، رونویسی، اپیژنومیک، یا دستکاری ژنتیک میزبان یا باکتریها برای خلق دیدگاههای بهتر و جدید درخصوص تعاملات میزبان و میکروب ادغام شدهاست. این امر در پیشرفتهایی نمایان شدهاست که با توجه به نحوهی تنظیم ویرولانس در پاتوژنهای فرصتطلب رخ دادهاند و اینکه این رویکرد چه فرصتهایی را برای کنترل آنها فراهم میآورد(باکس 8.1 را ببینید).
باکس 8.1. کوئوروم سنسینگ، ارتباط سلول به سلول باکتریایی، بعنوان یک هدف برای توسعهی درمان نوین
عفونت ناشی از پاتوژنهای باکتریایی به دلیل تولید عوامل مختلف ویرولانس، یعنی مولکولهای تولید شده توسط پاتوژنهایی که میتوانند آنها را قادر به کلونیسازی یا آسیب به میزبان سازند رخ میدهد(دیکی و همکاران، 2017). سیستمهای کوئوروم سنسینگ مکانیسمهایی هستند که توسط پاتوژنهای عمده میگو مانند گونه ویبریو متعلق به کلاد هاروی(یعنی وی.هاروی و گونههای مرتبط مانند وی.کامپلی و وی.پاراهمولیتیکوس) به منظور هماهنگ ساختن تولید چنین عوامل ویرولانسی مورد استفاده قرار میگیرند(دیفوردت، 2018). ژنهای عامل ویرولانس زمانی توسط پاتوژنها روشن میشوند که تراکم جمعیت آنها به سطحی کافی برای ایجاد عفونت در یک میزبان میرسد. برای سنجش تراکم جمعیت، این باکتریها از سه مولکول سیگنال مختلف، تحت عنوان هاروی اوتوندیوسر1(HAI-1)، اوتوندیوسر 2 و کلرا اوتندیوسر1 (CAI-1) (شکل 8.6(A-C)) برای فعال کردن فنوتیپهایی مانند بیولومینسنس، تولید متالوپروتئاز، سیدروفور و کیتیناز، و تحرک تاژکی استفاده میکنند(دیفوردت و همکاران، 2010؛ بسلر و هنک، 2004؛ هنک و همکاران، 2003؛ ناتراه و همکاران، 2011؛دیفوردت و یانگ، 2015). سیستم کوئوروم سنسینگ سه کاناله نیز برای ویرولانس کامل به سمت ارگانیسمهای آبزی مختلف از جمله میگوها مورد نیاز است(دیفوردت و سورجلوس، 2012؛ نور و همکاران، 2019؛ پاند و همکاران، 2013). به تازگی، مولکولهای سیگنال دیگری به مجموعه کوئوروم سنسینگ ویبریوها اضافه شدهاست که بیشترین مطالعات به ایندول آن اختصاص یافتهاست. سیگنالدهی ایندول، ویرولانس وی.کامپبلی برای میگوی آب شور و لاروهای میگوی رودخانه بزرگ را کنترل میکند(یانگ و همکاران، 2017).
یک گزینه برای کنترل بیماریزائی تنظیم شده به وسیله کوئوروم سنسینگ، شناسایی عواملی است که قادر به ایجاد تداخل در مکانیسمهای سیگنالدهی در باکتریهای بیماریزا است. فورانونهای هالوژنه شامل یکی از دستههای ترکیبات بازدارنده کوئوروم سنسینگ با بیشترین مطالعات از جمله ترکیبات طبیعی تولید شده توسط جلبکهای دریایی و مشتقات سنتتیک هستند(شکل 8.6(D, E)) (جانسنز و همکاران، 2008) و پتانسیل حفاظت از میگوها در مقابل ویبریوز را نشان دادهاند(دیفوردت و همکاران، 2006؛ پاند و همکاران، 2013). متاسفانه، این ترکیبات برای ارگانیسمهای بالاتر برای استفادهی کاربردی بسیار سمی هستند، و غلظتهای سمی تنها اندکی بیش از غلظتهای مختلکنندهی کوئوروم سنسینگ هستند. تریفنونهای حاوی بروم(شکل 8.6(F)) یک پتانسیل درمانی جالب را برای درمان ویبریوز در میگوها با شاخص درمانی تقریبی 100 نشان دادهاند دادهاند(دیفوردت و همکاران، 2012). دیگر ترکیب با فعالیت مختلکنندهی کوئوروم سنسینگ، ترکیب طعمدار غیرسمی سینامالدهید است(شکل 8.6(G)). مشخص شدهاست که این ترکیب در سیستمهای مختلف میکروب – آبزی میزبان موثر بودهاست(ناتراه و همکاران، 2012؛ پاند و همکاران، 2013). یک مزیت عمدهی این ترکیب با توجه به کاربردهای عملی این است که این ترکیب عموماً ایمن[6] تلقی میشود. علاوه بر ترکیبات خاص، طبق گزارشها، بسیاری از ارگانیسمهای دریایی(ریزجلبکها، بیمهرگان، قارچها و باکتریها) مهارکنندههای کوئوروم سنسینگ را تولید میکنند(سوراو و همکاران، 2017؛ تورس و همکاران، 2019). در بیشتر موارد، ساختار شیمیایی مهارکنندههای روشن نشدهاست. برخی از استثنائات مالینگولیدهای تولید شده توسط سیانوباکتریوم لینگبیا ماجوسکول(دوبرتساو و همکاران، 2010)، متابولیتهای فنتیل آمین تولید شده توسط هالوباسیلوس سالینوس(تیسدیل و همکاران، 2009) و 2.6 دی-ترت-بوتی-4-متیل فنول تولید شده توسط سیانوباکتریوم کروکوکوس تورگیدوس(سانتاکوماری و همکاران، 2018) هستند.
علاوه بر مهارکنندههای کوئوروم سنسینگ، یک مکانیسم ثانویه مختلکنندهی کوئوروم سنسینگ امکانپذیر است: غیرفعالسازی آنزیمی و تجزیه زیستی مولکولهای کوئوروم سنسینگ. توانایی تجزیه آسیل هوموسرین لاکتونها[7] بصورت گسترده در قلمرو باکتریایی توزیع شدهاست(دونگ و همکاران، 2007). غیرفعالسازی ترکیب سیگنال را میتوان با دو نوع عمده از آنزیمها تعدیل کرد: لاکتونازهای AHL و آسیلازهای AHL. لاکتونازهای تجزیه کنندهی AHL کدگذاریکننده ژنها در گونه باسیلوس شایع هستند(دونگ و همکاران، 2002). آنزیمهای تجزیهکنندهی AHL در بسیاری از باکتریهای دریایی تشریح شدهاند و آسیلازها شایعتر از لاکتونازها هستند(تورس و همکاران، 2019) و باکتریهای تجزیهکنندهی AHL از کشتهای میکروجلبکی و از مجرای گوارشی میگوهای سالم جدا شدهاند(دوفوردت و همکاران، 2011؛ پاند و همکاران، 2015).
علاوه بر رویکردهایی که در فعالیت خودِ سیستم کوئوروم سنسینگ مداخله میکنند، یک گزینه جایگزین، پیشگیری از رسیدن تراکم جمعیت پاتوژن به سطحی است که در آن ویرولانس را میتوان به وسیلهی کوئوروم سنسینگ فعال کرد. این ایدهی اساسی رویکرد توصیف شده در بخش “پایداری میکروبی بعنوان مفهوم اساسی در مدیریت میکروبی پایدار” در همین فصل است.
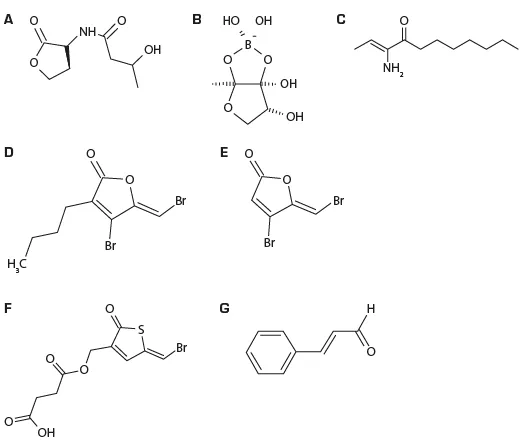 شکل 8.6. ساختار شیمیایی مولکولهای سیگنال کوئوروم سنسینگ تولید شده توسط ویبریوهای کلاد هاروی و مهارکنندههای کوئوروم سنسینگ.
شکل 8.6. ساختار شیمیایی مولکولهای سیگنال کوئوروم سنسینگ تولید شده توسط ویبریوهای کلاد هاروی و مهارکنندههای کوئوروم سنسینگ.
(A) هاروی اوتویندوسر-1 (HAI-1)، ان-(3هیدروکسی بوتانول)-ال-هوموسرین لاکتون.
(B) اوتویندوسر -2 (AI-2)، فورانوزیل بورات دیاستر 3ال-متیل-5-6-هیدرو-فور(2.3-دی)(1.3.2) دیوکسابورول-2.2.6.6 ای تترائول.
(C) کلرا اوتویندوسر -1، (اس) -3-هیدورکسیتریدیکان-4.
(D) فورانون طبیعی-4-برومو-5-(برومومتیلن)3 3-بوتیل-2(5اچ)-فورانون (5ز) تولید شده توسط جلبک دریایی قرمز دلیسا پاکرا.
(E) مشتق سنتتیک (5ز) -4-برومو5 (برومومتیلن)-(5اچ) – فورانون.
(F) تریفنون برومدار جی ز -( 5- برومتیلن(2- اکسو-2.5 دیهیدروتیوفن-3ی ال)متوکسی)-4-اکسو-بوتانیک اسید. سینامالدهید.
نقش فناوریهای امیکس در تشریح قابلیت عملکرد زیستگاه میکروبی
افزایش استفاده از متاژنومیک تحت شرایط میدانی بیانگر نتایجی تقریباً امیدوارکننده است و تعداد بالای مطالعات نیز بر توصیف و قابلیت کارکرد زیستگاه میکروبیهای میگو متمرکز بودهاست، چنانچه در پژوهش کورنجو-گرانادوس و همکاران(2018) و لی و همکاران(2018) نیز شرح داده شدهاست. چنین مطالعاتی از آن جهت مهم هستند که اطلاعات راجع به اینکه چه چیزی توسعه جمعیت میکروبی باکتریایی در طی مراحل مختلف یک چرخه عمر میگو را کنترل میکند را فراهم میسازند، اما حتی دیدگاهی را نیز درخصوص نحوهی ارتباط کل اجتماع باکتریایی با وضعیت سلامت و عملکرد میگو ارائه میدهد. برای مثال، فان و همکاران(2019) تلاش کردند تا دینامیک جمعیت میکروبی روده را به عملکرد رشد میگو ربط دهند؛ کورنجو-گرانادوس و همکاران(2017) و چن و همکاران(2017) سعی کردند ترکیب جمعیت میکروبی روده را به شیوع بیمار AHPND ارتباط دهند؛ ژانگ و همکاران(2019) سعی کردند جمعیت میکروبی آب و رسوب را به کیفیت محیطی ربط دهند؛ یائو و همکاران(2018) و زو و همکاران(2016) سعی کردند ترکیب جمعیت میکروبی روده را به شیوه بیماریها ارتباط دهند و لندسام و همکاران(2019) نیز به بررسی اثرات رویههای پرورش میگو بر اجتماع میکروبی روده پرداختند. لازم به ذکر است که تمامی این مطالعات در یک دوره 5 ساله قبل از نوشتن این فصل منتشر شدهاند. این پژوهشها به مجموعه دانش درخصوص زیستگاه میکروبی در طی پرورش میگو کمک میکند، اما متاسفانه اطلاعات عینی اندکی برای کاربرد عملی فراهم میسازند، چون مشخص نیست که آیا نتیجهگیریهای آنها وابسته به سیستم هستند تا در سطح جهانی معتبرند. در زمینه بیماری، نیاز به اقدامات پژوهشی هماهنگ در سطح جهانی برای یافتن پاسخهایی برای سوالات اولیه زیر احساس میشود.
- یک ترکیب اجتماع باکتریایی نرمال در مجرای گوارشی یا محیط پرورش میگوی سالم در مراحل مختلف حیات شبیه به چه چیزی است؟
- آیا الگوهایی وجود دارد که بصورت جهانی حفظ شده باشند یا آیا چنین الگوهایی باید برای هر محل/گونه/چرخه پرورش بصورت مجزا باید تعیین شود؟
- رابطهی بین اجتماع باکتریایی روده و اجتماع باکتریایی در محیط پرورش میگو در مراحل مختلف عمر چیست؟
برای تعیین اینکه آیا مدیریت میکروبی باید استقرار یک جمعیت میکروبی متشکل از فیلوتیپهای باکتریایی خاص را هدف قرار دهد، باید پاسخی برای این سوال بیابیم که آیا یک زیستگاه میکروبی خط مبنای خاص برای میگوی سالم وجود دارد. تا به امروز، بیشتر مطالعات تنها گروههای باکتریایی غالب مرتبط با میگو در مراحل انتخابی رشد را شرح دادهاند. برخی از این مطالعات تحت شرایط آزمایشگاهی انجام شدند(مانند هوانگ و همکاران، 2014)، اما بیشتر آنها مطالعات میدانی بودند(مانند هو و همکاران، 2016؛ هوانگ و همکاران، 2014؛ زوکرات و همکاران، 2018). اگرچه تعداد مطالعات توصیفی رو به افزایش است، اما به خوبی میتوان گفت که این تعداد برای استخراج نتایج با توجه به الگوهای حفاظت شدهی جهانی بیش از حد محدود است. به بیان دقیقتر، از آنجائیکه مولفههای مطالعات(از جمله عواملی مانند مکان نمونه، انتخاب نمونه، حفظ نمونه، و پروتکلهای آنالیز) بسیار متنوع هستند، زمانی که فراتحلیلها انجام میشوند، سوءگیری قابل توجهی وجود دارد(کورنجو- گراندوس و همکاران، 2018؛ یو و همکاران، 2018).
علاوه بر جمعآوری دادههای ترکیبی(ساختاری) درخصوص زیستگاه میکروبی روده و محیط میگو در مراحل مختلف عمر، رابطهی بین این دو از اهمیت یکسانی برخوردار است. برای جوانترین مراحل عمر حیوانات پرورشی، این مطلب بیان شدهاست که کلونیسازی باکتریایی اولیه میتواند پیامدهای ماندگاری داشتهباشد(دی اسکرایور و وادستین، 2014)، هرچند تاثیر دقیق آن نامشخص باقی ماندهاست. علاوه بر این، اکنون این ابهام وجود دارد که کلونیسازی اولیه چگونه رخ میدهد؛ برای مثال، نقش نسبی جمعیت میکروبی آب در مقابل جمعیت میکروبی غذا چیست و انتخاب در مقابل فرایندهای تصادفی چگونه است. پی بردن به اینکه پیوند ساختاری بین جمعیت میکروبی محیطی و رودهای تا چه اندازه قوی است برای تعیین این امر مهم است که آیا کلونیسازی اولیه را میتوان کنترل کرد و آیا هدفگیری یک جمعیت میکروبی خاص در مراحل اولیه رشد میگو واقعبینانه است. علاوه بر این، اگر یک جمعیت میکروبی اصلی در کل عمر میگو وجود داشتهباشد، حاکی از آن است که دستکاری جمعیت میکروبی روده در اولین مراحل عمر بر جمعیت میکروبی در ادامه حیات تاثیرگذار است. تعیین وجود یک جمعیت میکروبی اصلی نیز اطلاعاتی درخصوص این امر فراهم میآورد که آیا دستکاری در مراحل بعدی رشد کماکان امکانپذیر خواهد بود و اینکه درجه مقاومت در برابر تهاجم توسط یک جمعیت میکروبی مشخص چقدر است. دو بعد آخر کاملاً به مفهوم استفاده از پروبیوتیکها بعنوان یک استراتژی مدیریت میکروبی ارتباط دارند.
شمار محدودی از مطالعات بر پاسخ به این سوالات متمرکز بودهاند. زیونگ و همکاران(2017) شرح دادند که برای لاروهای میگو، اهمیت مشابهی از فرایندهای قطعی(یعنی انتخاب محور) و تصادفی در کنترل جمعیت میکروبی روده وجود داشتهاست. این امر حاکی از آن است که فرصتهایی ممکن است برای استقرار یک اجتماع میکروبی خواسته شده در روده لاروهای میگو وجود داشتهباشد. زیونگ و همکاران(2015) به آنالیز اجتماعات باکتریایی در نمونههای روده و آب از استخرهای میگو پرداختند. آنان دریافتند که فراوانی ردههای غالب اساساً بین دو نوع نمونه متفاوت است. این مطلب تایید کرد که نیروهای گزینشی قطعی برای ساختار جمعیت میکروبی در روده میگو مهم هستند و اینکه جمعیت میکروبی روده صرفاً جمعیت میکروبی در آب را منعکس نمیکند. هو و همکاران(218) به همین نتیجه دست یافتند. آنان مشاهده کردند که علیرغم اشتراک در تعداد قابل توجهی از واحدهای آرایهشناختی عملیاتی، فراوانترین آرایهها دارای تفاوت معناداری بین اجتماعات میکروبی محیطی و روده بودند. این مطلب نشان داد که عوامل محیطی در روده، اجتماع باکتریایی خود را شکل میدهند. علاوه بر این، زیونگ و همکاران(2019) دریافتند که شباهتها در جمعیت میکروبی روده بین میگوهای پرورش یافته در مکانهای دور بالاتر از شباهت بین میگوها و آب پرورشی مربوطه آنها بودهاست. تمامی این اطلاعات حاکی از آن است که مدیریت هدفمند جمعیت میکروبی روده از طریق دستکاری ترکیب در آب میتواند محتمل باشد، اما سرراست نیست. یک استراتژی احتمالی میتواند افزایش تعداد باکتریها در آب در ترکیبی باشد که بیشتر به جمعیت میکروبی میگوهای سالم شباهت دارد. همانگونه که میگوها به احتمال زیاد باکتریها را از استخرهای با فراوانی بیشتر انتخاب میکنند، شانس بیشتری برای هدایت جمعیت میکروبی به سمت جمعیت میکروبی سالم وجود دارد، چنانچه احتمال استقرار یک جمعیت میکروبی سالم نیز افزایش مییابد. برای لارو ماهیان، نشان داده شدهاست که میتوان تغییرپذیری، برای مثال، یک افزایش 70 درصدی در بقای لارو، را از طریق دستکاری جمعیت میکروبی آب کنترل کرد(وادستین و همکاران، 2018). لازم به ذکر است که مطالعات نقل شده درخصوص میگوها، لحظات کلونیسازی اولیه(یعنی در باز شدن دهان) را در آنالیز خود مدنظر قرار نمیدهند. این لحظهی کلونیسازی میکروبی محیط روده در میگوها مستلزم توجه ویژهای در تحقیقات آیندهاست، چنانچه این احتمال بیشتر وجود دارد که این کلونیسازی اولیه به جای تاثیرگذاری بر یک جمعیت میکروبی از پیش موجود، کنترل شود(دی.اسکرایور و وادستین، 2014). علاوه بر این، مشخص است که ترکیب باکتریایی روده به نحوی اساسی از یک مرحله عمر به مرحلهای دیگر تغییر میکند که شاید به این علت است که محیط روده تحت رشد مستمر قرار دارد. به دلیل فشار گزینشی کمتر در روده در مقایسه با مراحل بلوغ، مراحل لاروی میگوها احتمالاً بهترین دوره برای مدیریت جمعیت میکروبی روده باشند(زیونگ و همکاران، 2017، 2019).
در زمان ارزیابی احتمالات برای دستکاری اجتماع باکتریایی روده در مراحل بعدی رشد، زیونگ و همکاران(2017) دریافتند که از پستلارو(در روز 28) تا بلوغ(در 77 روز)، اجتماع عمدتاً توسط فرایندهای قطعی تعیین میشد. این مطلب نشان میدهد که مدیریت اجتماع باکتریایی روده در این مراحل باید مبتنی بر دانش درخصوص فرورفتگیهای موجود در محیط روده(مثلاٌ در زمان استفاده از پروبیوتیکها) باشد. نتایج حاصل از پژوهش میراندا- بایز و همکاران(2020) نشان دادند که کلوخههای باکتریایی در آب در طی مراحل میگوی بالغ شامل اجتماعات باکتریایی مشخصی هستند که تغییر آنها به طور مستقیم با افزودن پروبیوتیکها دشوار است. با این وجود، نتایج این مطالعات به این معنا نیست که پروبیوتیکها نمیتوانند هیچگونه تاثیر مثبتی داشتهباشند. حتی میکروبهای گذرا که به اعضای تجمعات در روده تبدیل نمیشوند، فعال هستند و بر میزبان تاثیر میگذراند(مثلاً، با تولید متابولیتها). به طور خاص در میگوها، به دلیل دفع مدفوع و رفتار مدفوعخواری، پراکندگی پیوستهی میکروبها بین حیوانات و محیط وجود دارد. این امر حاکی از آن است که تعیین واقعی پروبیوتیکها در جمعیت میکروبی روده میگوها نباید یک ضرورت برای دستیابی به این نتیجه تلقی شود که کاربرد پروبیوتیکها موفقیتآمیز است. برای ماهیان، حتی نشان داده شدهاست که پراکندگی بین میزبان، ردههای باکتریایی با استراتژیهای سابقه عمر دارای پراکندگی و کلونیسازی تکراری انواع میزبان را انتخاب میکند(برنز و همکاران، 2017).
حتی مهمتر اینکه وضعیت ساختاری اجتماع باکتریایی در روده میگو و محیط، عملکرد اجتماعات باکتریایی مختلف برای زیستپذیری میزبان است. این مطلب منجر به دو سوال زیر میشود.
- آیا فیلوتیپهای باکتریایی را میتوان در روده یا محیط پرورش میگو بعنوان شاخصهای وضعیت سالم میگو در مراحل مختلف عمر یا شاخصها یا پیشبینهایی از یک وضعیت بیماری شناسایی کرد؟
- آیا دینامیک (پویایی) در ترکیب اجتماع باکتریایی در مجرای گوارشی یا محیط پرورش میگو در مراحل مختلف عمر را میتوان بعنوان شاخصی از خطر بیماری مورد استفاده قرار داد؟
در طی صحبتهایش راجع به “بیماریها در آبزیپروری میگو؛ مسیرهای احتمالی درمان” در جلسهی جامعهی متخصصان آبزیپروری در کنفرانس آبزیپروری آسیا اقیانوسیه 2019 در چنای هندوستان، پروفسور ارون دهار بر نیاز به روشهای تشخیصی تاکید داشت که امکان تشخیص پاتوژنها را درست قبل از نقطهای که در واقع در آنجا یک شیوع بیماری رقم میخورد را فراهم میسازد. ما موافقیم، اما اضافه میکنیم که تشخیص پاتوژنها به تنهایی کافی نیست. پروفسور جینبو زیونگ و همکارانش (زیونگ و همکاران، 2016) بیان کردند که شاخصهای کیفیت آب و فراوانی پاتوژنهای خاص، که در حال حاضر شاخصهای اصلی بیماری میگو به شمار میروند، پیشبینیهای نادرستی از بیماری میگو ارائه میدهند. برای مثال، استفاده از شمارش گونهی ویبریو به تنهایی برای پیشبینی شیوع بیماریها بهینه نیست، چونکه ویبریوها نیز همواره درون و اطراف میگوهای سالم مشاهده میشوند. لذا، نیاز به رویکردهای جایگزین برای پیشبینی بیماری در مرحله اولیه با دقت بالا احساس میشود(شکل 8.7). استفاده از گروهی از انواع باکتریایی شاخص یک مفهوم جالب است، چنانچه فراتر از تشخیص صرف عوامل سببی مشخص برای ارزیابی خطر بیماری است. این مفهوم به تشخیص دامنهی خاصی از باکتریها و نه ضرورتاً عوامل سببی یک بیماری خاص که اغلب بیانگر کسر کوچکی از کل اجتماع میکروبی، اما دال بر وضعیت سلامت میگوی پرورشی هستند، متکی است. به بیان دیگر، آنها از این پتانسیل برخوردارند که شاخصهای اولیه دیسبیوزیس باشند. دای و همکاران(2018) به این مطلب بعنوان مفهوم دروازهبان میکروبی اشاره کردند و تغییرات در فراوانیهای نسبی باکتریهای دروازهبان بصورت نامتناسبی کل اجتماع را دچار مخاطره کرده و بر پایداری و قابلیت عملکرد آن تاثیر میگذارند.
با توجه به مفهوم باکتریهای شاخص، ژانگ و همکاران(2014) گروهی از شش مرتبه باکتریایی را یافتند که بعنوان شاخصی از وضعیت سالم عمل میکردند و گروهی از پنج مرتبه باکتریایی که بیانگر میگوی بیماری بودند. علاوه بر این، زیونگ و همکاران(2014) دریافتند که فیلوتیپهای باکتریایی شاخص بیماری را میتوان در میگوی پرورشی شناسایی کرد. تغییرات در فراوانی نسبی 13 فیلوتیپ شاخص در سطح خانواده(هفت مورد دال بر وضعیت سالم و شش مورد بر وضعیت بیماری) میتوانند یک وضعیت بیماری با دقت بیش از 79 درصد را پیشبینی کنند. علاوه بر این، پژوهش زیونگ و همکاران(2015) دامنهای از آرایههای شاخص برای یک وضعیت سالم یا بیمار میگو را شناسایی کردند.
فراوانیهای بالای باسیلی، فلاووباکتریاها، اسیدومیکروبیالها و الترومونادالها حاکی از میگوی سالم بودند، در حالی که فراوانیهای بالای اکتینومایستالها، اسفینگوباکتریال ها و ویبریونال ها بیانگر میگوی بیمار بودند. این مشاهدات هیچ نتیجهای درخصوص علیت را نشان ندادند و فرضیات راجع به قابلیت عملکرد واقعی تنها مبتنی بر اکولوژی مشخص فیلوتیپهای شاخص مطرح شدند. در مطالعات بیشتر توسط زیونگ و همکاران(2017، 2019)، مشخص شد که عمر میگوی پرورشی را باید در زمان استفاده از مفهوم فراوانیهای نسبی آرایهی تمایز بیماری برای پیشبینی بیماری مدنظر قرار داد. در حقیقت، فیلوتیپهای شاخص باکتریایی برای عمر میگو نیز مشخص شدند و زمانی که این آرایههای باکتریایی تمایز سن در نظر گرفته میشوند، دقت پیشبینی وضعیت بیماری میگوهای پرورشی را میتوان تا 5/91 الی 5/95 درصد افزایش داد.
پیش بینی بیماری قبل از شیوع با صحت و دقت بالا
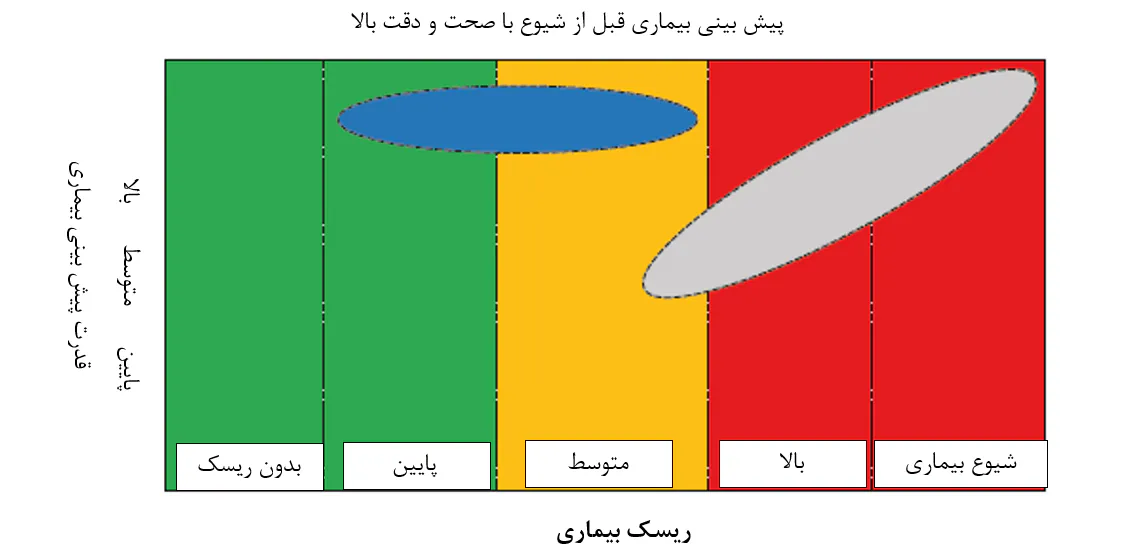 8.7. روشهای تشخیص بیماری در مواردی به کار برده میشوند که پرورشدهندگان میگوها به وجود بیماری شک کنند. در عمل، اینها اغلب زمانی تشخیص موثر را فراهم میسازند که درمان وضعیت خیلی دیر شدهاست(ناحیه خاکستری). این امر حتی برای ابزار تشخیص سمت استخر نیز به کار میروند که در حال حاضر راه خود را به سمت بازار یافتهاند. هدف ابزار آینده پیشبینی بیماری باید پیشبینی دقیق خطر بیماری در مرحله اولیهاست که به پرورشدهنده زمان زیادی برای اجرای یک درمان میدهد(ناحیه آبی).
8.7. روشهای تشخیص بیماری در مواردی به کار برده میشوند که پرورشدهندگان میگوها به وجود بیماری شک کنند. در عمل، اینها اغلب زمانی تشخیص موثر را فراهم میسازند که درمان وضعیت خیلی دیر شدهاست(ناحیه خاکستری). این امر حتی برای ابزار تشخیص سمت استخر نیز به کار میروند که در حال حاضر راه خود را به سمت بازار یافتهاند. هدف ابزار آینده پیشبینی بیماری باید پیشبینی دقیق خطر بیماری در مرحله اولیهاست که به پرورشدهنده زمان زیادی برای اجرای یک درمان میدهد(ناحیه آبی).
علاوه بر استفاده از گروهی خاص از باکتریها بعنوان شاخص سلامت یا بیماری، تغییر موقت کلی در اجتماع میکروبی میتواند یک پیشبینی دقیقتر از بیماری آینده باشد. دیسبیوزیس(یعنی ناپایداری میکروبی) اغلب به بیماری ناشی از پاتوژنهای فرصتطلب ارتباط دارد، موقعیتی که اغلب تحت شرایط محیطی نامساعد تقویت میشود و منجر به استرس و حساسیت بیشتر بیماری در بین حیوانات پرورشی میگردد(شکل 8.8). همانگونه که میکروارگانیسمها به طور کلی، اولین پاسخدهندگان به اختلالات هستند، انتظار میرود که تشخیص دیسبیوزیس در میگوها پیش از علائم فیزیکی بیماری میگو رخ دهد(زیونگ، 2018). تشخیص اولیهی دیسبیوزیس ممکن است بعنوان یک رویکرد جایگزین برای پیشبینی بیماری مورد استفاده قرار بگیرد. این تشخیص بیانگر پیشرفت چشمگیری در شیوهی کنونی است که طبق آن بیماری در میگوهای پرورشی تشخیص داده میشود. برای چنین رویکردی، نیاز به تعیین یک خط مبنا برای پویایی در اجتماعات میکروبی روده که بیانگر موقعیت سالم نرمال هستند، احساس میشود. زیونگ و همکاران(2014) دریافتند که تغییرات در اجتماعات باکتریایی در استخرهای مختلف بیانگر الگوهای جانشینی مشابهاست که نشان میدهد پویایی موقتی در اجتماع باکتریایی تاحدودی قابل پیشبینی است. زیونگ و همکاران(2017، 2018، 2019) شرح دادند که تغییر در ترکیب اجتماع باکتریایی روده پیشرفت منظمی را در طی بزرگ شدن میگو به نحوی قابل پیشبینی پشت سر میگذارد. جالب اینکه، بیماری میگو در الگوهای مورد انتظار اختلال ایجاد میکند. لذا، یک انحراف از این خط مبنا میتواند نشانهای یا حتی پیشبینی از بیماری بعدی میگو باشد. پژوهش زیونگ و همکاران(2017) ارتباط نزدیکی با این مفهوم دارد، چنانچه مبتنی بر کاربرد آرایههای باکتریایی تمایز سن است تا تعیین کند که آیا پویایی موقتی ناشی از عمر است یا دیسبیوزیس(شکل 8.9). یک نکته نهایی که توسط زیونگ و همکارانش بیان شد این است که باید تعیین نمود که آیا مفهوم آرایههای تمایز سن و بیماری برای محصولات صادق است. علاوه بر این، اعتبار این مفهوم امیدوارکننده باید برای طیفی از روشهای مختلف پرورش، شرایط و مکانها به منظور بررسی جهانشمول بودن آن مورد ارزیابی قرار بگیرد.
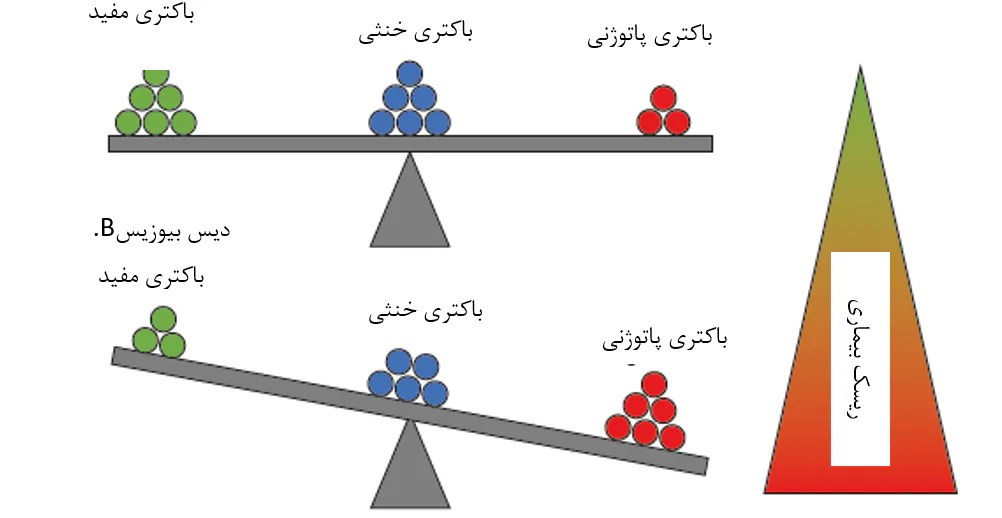 شکل 8.8. یک مدل مفهومی برای رابطهی بین ترکیب اجتماع میکروبی و خطر بیماری میگو، که توسط زیونگ و همکاران(2016) ارائه گردیدهاست. در موقعیت تعادل میکروبی، تعداد و فعالیتهای باکتریهای مفید و خنثی، فعالیت باکتریهای پاتوژنی را تحت کنترل حفظ میکنند(A). این امر منجر به خطر پایین بیماری پاتوژنی برای میگوی پرورشی میشود. در موقعیت دیسبیوزیس، تعادل میکروبی مختل شدهاست و احتمالاتی را برای باکتریهای پاتوژنی برای افزایش تعداد یا فعالیت ایجاد میکند(B). تشخیص دیسبیوزیس در یک مرحله آغازین ممکن است یکی از اولین شاخصهای بیماری آینده باشد.
شکل 8.8. یک مدل مفهومی برای رابطهی بین ترکیب اجتماع میکروبی و خطر بیماری میگو، که توسط زیونگ و همکاران(2016) ارائه گردیدهاست. در موقعیت تعادل میکروبی، تعداد و فعالیتهای باکتریهای مفید و خنثی، فعالیت باکتریهای پاتوژنی را تحت کنترل حفظ میکنند(A). این امر منجر به خطر پایین بیماری پاتوژنی برای میگوی پرورشی میشود. در موقعیت دیسبیوزیس، تعادل میکروبی مختل شدهاست و احتمالاتی را برای باکتریهای پاتوژنی برای افزایش تعداد یا فعالیت ایجاد میکند(B). تشخیص دیسبیوزیس در یک مرحله آغازین ممکن است یکی از اولین شاخصهای بیماری آینده باشد.
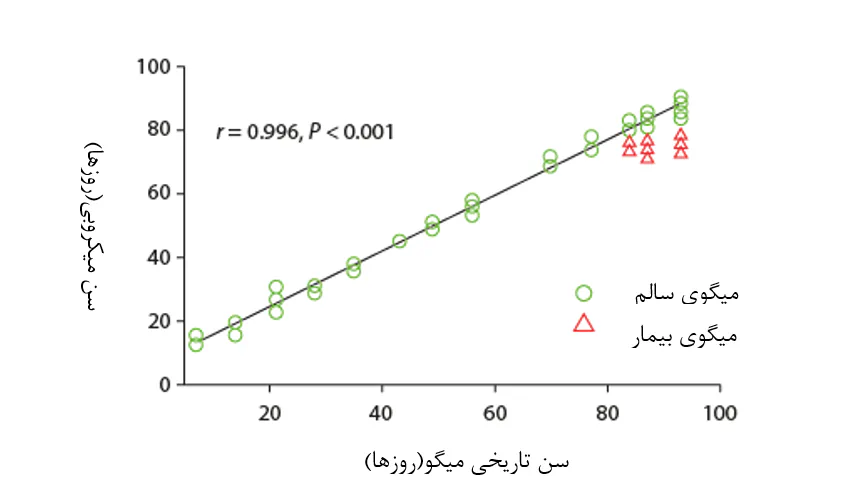 شکل 8.9. زیونگ و همکاران(2017) دریافتند که فراوانی نسبی آرایههای باکتریایی خاص در زیستگاه میکروبی روده میگو، پیشبینی برای عمر میگو تحت شرایط تعادل میکروبی است(نقاط داده سبز رنگ) و اینکه انحرافات از شرایط نرمال میتواند شاخصی از دیسبیوزیس باکتریایی و به دنبال آن افزایش خطر بیماری(نقاط داده قرمز) باشد.
شکل 8.9. زیونگ و همکاران(2017) دریافتند که فراوانی نسبی آرایههای باکتریایی خاص در زیستگاه میکروبی روده میگو، پیشبینی برای عمر میگو تحت شرایط تعادل میکروبی است(نقاط داده سبز رنگ) و اینکه انحرافات از شرایط نرمال میتواند شاخصی از دیسبیوزیس باکتریایی و به دنبال آن افزایش خطر بیماری(نقاط داده قرمز) باشد.
مفاهیم بالا به اجتماعات خاص باکتریها یا پویایی بین آنها اشاره دارد که بعنوان شاخصهای شیوع بیماری مورد استفاده قرار گرفتهاند. با این وجود، بیماری وابسته به زمینه است، به این معنا که تحت تاثیر میزبان و شرایط محیطی قرار دارد. برای مثال، تغذیه مستمر میگوها در طی یک چرخه پرورش بر متغیرهای فیزیکی شیمیایی آب تاثیر میگذارد. تنزل کیفیت آب تنش را بر میگو تحمیل میکند و آنها را بیشتر مستعد مداخله منفی پاتوژنهای فرصتطلب میکند. در نتیجه، هم توسعه جمعیتهای باکتریایی بالقوه مضر و هم حساسیت حیوانات به این جمعیتها به متغیرهای فیزیکی شیمیایی در آب و روده بستگی دارد. این ترکیب در نهایت منجر به وضعیت بیمار میگوها میشود. بالعکس، وضعیت بیماری میگوها ممکن است بر ترکیب جمعیت میکروبی مرتبط با آنها تاثیر بگذارد و آنها را بیشتر مستعد تاثیرپذیری منفی باکتریها نماید. باس و همکاران(2019) اظهار داشت که تغییری از پارادایم “یک پاتوژن – یک بیماری” به مفهوم پاتوبیوم[8] وجود دارد که تعامل موجودات همزیست، میزبان و محیط در درک جدیدی از اتیولوژی بیماری را ادغام میکند. این بدان معناست که علاوه بر زیستگاه میکروبی، سایر متغیرهای بیولوژیکی(میزبان) و متغیرهای فیزیکی شیمیایی(محیط) بایستی در زمان توجه به خطر بیماری مدنظر قرار بگیرند. این امر منجر به پیچیدگی بالای متغیرهای مرتبط بهم میشود که تفسیر آنها بدون ابزار کافی غیرممکن است. زیونگ(2018) یک مدل مفهومی را برای تعامل بین زیستگاه میکروبی، عوامل خارجی و بیماری میگو ارائه داد. او اظهار داشت که تهاجم و کلونیسازی توسط پاتوژنهای میگو توسط فشار محیطی، انتخاب میزبان، و مقاومت در برابر کلونیسازی تحمیلی از جانب همغذاها مورد مخالفت قرار میگیرد. در میگوهای بیمار، تعادل در همغذاهای حفاظت و امنیت میزبان به وسیله اختلالات خارجی دچار مخاطره میشود. برای مثال، تنزل کیفیت آب و رسوب میتواند میگوها را دچار تنش کرده و جمعیت میکروبی روده آنها را تغییر دهد و رشد پاتوژن فرصتطلب را ارتقا داده و یا بیان عوامل ویرولانس را القا نماید. این تغییرات بصورت جمعی فرورفتگیهای اکولوژیکی را برای تهاجم بیشتر توسط پاتوژنها باز میکنند.
مفهوم پاتوبیوم یک مسئله بسیار جدید در تولید آبزیپروری است و برحسب دانستههای ما، هیچ تحقیقی بر باز کردن تعاملات پیچیدهای که ممکن است بین میزبان، زیستگاه میکروبی و محیط در زمینه توسعه بیماری رخ دهد متمرکز نبودهاست. رویکردهای چند اُمیکسی(از جمله متاژنومیک، متارونویسیک و متاپروتئومیک) برای خلق دادههای لازم برای چنین آنالیزی مورد نیاز هستند و فناوری یادگیری ماشین را نیز میتوان برای کشف عوامل با توان پیشبینی به کار برد. براساس مفهوم پاتوبیوم، وضعیت متغیر سیمبیوم ممکن است امکان تشخیص در مرحله اولیه بیماری را درست قبل از پدیدار شدن علائم و نشانههای خاص بیماری در سطح میزبان فراهم سازد.
درک بهتر قابلیت عملکرد اجتماع میکوبی در سیستمهای پرورش میگو: الزامی برای یک پروژه زیستگاه میکروبی میگو
مطالعات ذکر شده در بخش پیشین که با پیشبینی کمی بیماری براساس آرایههای شاخص، پویایی در ترکیب جمعیت میکروبی روده یا توسعه یک پاتوبیوم سروکار دارند، با تنوع محدودی از شرایط محیطی، تعداد محدود نمونهها یا عمر محدود و تغییرپذیری موقت انجام شدند. برای مثال، زیونگ و همکاران(2017) از شش استخر نمونهبرداری کردند، آن را به استخرهای سالم و بیمار در طی یک محصول تقسیمبندی کردند، در حالی که زیونگ و همکاران(2019) از نمونههایی از 11 استخر در دو مکان در طی یک محصول استفاده کردند. تمامی 18 مطالعه که در فراتحلیل گنجانده شدند، توسط کورنج-گرانادوس و همکاران(2018) انجام شدند که روی هم رفته در مجموع بیانگر 199 نمونه بودند، در حالی که پنج مطالعه که در فراتحلیل یو و همکاران(2018) لحاظ شد در مجموع بیانگر 99 نمونه بودند. این فراتحلیلها برای توصیف زیستگاه میکروبی میگو و تعیین میزبان و عوامل محیطی که آن را شکل میدهند(کورنجو – گرانادوس و همکاران، 2018) یا برای تعیین آثار جهانی که میتوان برای تشخیص وقوع بیماری مورد استفاده قرار داد، انجام شدند. متاسفانه، این تلاشها فاقد پروتکلهای آزمایشی و بیوانفورماتیک متفاوت بودند که منجر به تعداد پایین پژوهشهایی شد که میتوان در فراتحلیلها گنجاند. در نتیجه، دستیابی به نتایج کلی دشوار است. به همین دلیل، نیاز به پژوهش جهانی درخصوص زیستگاه میکروبی میگو از جمله محیطهای آکادمیک و صنعت، احساس میشود. پروتکلهای هماهنگ متاژنومیک و بیوانفورماتیک باید در یک سری آزمایشها در یک مبنای بلند مدت و در دامنه وسیعی از سیستمها و شرایط پرورش به کار گرفته شوند. تنها پس از آن حجم لازم اطلاعات توصیفی درخصوص زیستگاه میکروبی در روده و محیط پرورش میگو در مراحل مختلف عمر را میتوان خلق کرد. چنین اطلاعاتی برای رفتن به نسل بعدی رویکردهای مدیریت میکروبی بسیار حیاتی هستند، چنانچه در باکس 8.2 خلاصه شدهاست.
باکس 8.2. پروژه زیستگاه میکروبی میگو
هدف یک پروژه زیستگاه میکروبی میگو، تعیین وضعیت مبنا در ترکیب زیستگاه میکروبی میگو و توسعهی یک مدل پیشبین برای مدیریت میکروبی است که بعنوان ابزاری برای پیشبینی کیفی وقوع و شدت شیوع بیماریها به کار میرود. متغیرهای ارزیابی واقعبینانه مبتنی بر تغییرات موقتی در جمعیت میکروبی را باید شناسایی کرد تا وقوع بعدی و شدت بیماری پیشبینی شود. چنین رویکردی ممکن است مستقل از تشخیص پاتوژنهای سببی خاص باشد، هرچند این رویکرد برای پاتوژنهای اجباری که برحسب تشخیص بعنوان عامل بیماری شناخته میشوند، ارزشمند خواهد ماند. وجود کمی آرایههای شاخص باکتریایی مشترک جهانی برای بیماری را نیز میتوان برای ارزیابی خطر بیماری و پیشبینی بالقوه شدت بیماری مورد استفاده قرار داد.
تا به امروز، بیشتر تحقیقات بر تجزیه و تحلیل جمعیت میکروبی در روده میگوهای پرورشی متمرکز بودهاند، چنانچه به لحاظ منطقی تصور میشود که این میکروارگانیسمها دارای بالاترین ارتباط برای وضعیت سلامت حیوانات هستند. باوجود این، زیونگ و همکاران(2014)، از امضاهای میکروبی در آب برای نشان دادن این مسئله استفاده کردند که اجتماعات باکتریایی شاخص در آب را میتوان برای پیشبینی وقوع بیماری میگو به کار برد و به دقت پیشبینی بیش از 79 درصد دست یافتند. استفاده از نمونههای آب برای پیشبینی بیماری آسانتر از نمونههای روده است، چون میتوان به آسانی آنها را در هر نقطه زمانی در طی پرورش برداشت کرد و نیازی به تشریح میگوی نمونهبرداری شده نیست. چنین رویکردی اساساً سهولت نمونهبرداری را افزایش داده و خطر سوءگیریهای مرتبط با پروتکل را کم میکند. قدرت پیشبینی نمونههای روده در مقابل نمونههای آب را باید با هم مقایسه کرد و این امر مستلزم آن است که انواع نمونه در یک زمان برداشت شوند.
جنبه دیگر از تحلیلهای مبتنی بر اُمیکس برای پیشبینی بیماری در طی پرورش میگو این است که در حال حاضر فناوری امکان پایش در سایت و در خط را فراهم نمیسازد. پس از نمونهبرداری، نمونهها را باید در آزمایشگاههای تخصصی با تجهیزات توالییابی خاص پردازش و آنالیز کرد و به دنبال آن، پردازش داده با استفاده از ابزار بیوانفورماتیک انجام شود. این رویه کماکان مستلزم زمان قابل توجهی است که بر مفهوم استفاده از اجتماعات باکتریایی بعنوان پیشبینیهای بیماری بعدی تاثیرگذار است. این مسئله با این واقعیت مورد تاکید قرار میگیرد که پویایی باکتریایی میتواند ظرف چند دقیقه تا چند ساعت تغییر کند. در کنفرانس جهانی آبزیپروری 2010(FAO/NACA، 2012) در طی مباحث پانل کارشناسی با موضوع “بهبود امنیت زیستی: ضرورتی برای پایداری آبزیپروری”، گفته شد که:
«تشخیص سریع بیماری برای پایداری آبزیپروری بسیار حیاتی است و پیشرفت سریع در فناوری زیستی در طی دهه گذشته، امکان توسعه و بهبود دامنه وسیعی از تکنیکهای مولکولی و تشخیص ایمنی را فراهم ساختهاست و واکنشگرها و کیتها بیشتر در دسترس قرار گرفتهاند. در سالهای اخیر، روشهای توسعه یافته برای طب بالینی و دامپزشکی به منظور استفاده در آبزیپروری تعدیل یافته و بهینهسازی شدهاند. علیرغم این امر، شناسایی پاتوژنهای خاص دشوار است و برخی از روشهای توسعه یافته برای اجرا و تفسیر بسیار پیچیده هستند. روشهای سنتی جداسازی و توصیف پاتوژن پرهزینه، کاربر و کند هستند و ممکن است تشخیص قطعی را ارائه ندهند. برای بسیاری از روشهای سریع، پاتوژنهای زنده و مرده را نمیتوان تمایز داد؛ بنابراین، روشهای غنیسازی و استفاده از کیتهای زنده/مرده، روشهای تکمیلی مفیدی به شمار میروند. تفسیر نتایج با استفاده از روشهای سریع باید با سایر شواهد بالینی مدنظر قرار بگیرد.»
مطلب بالا حاکی از آن است که علاوه بر تولید دانش درخصوص قابلیت عملکرد زیستگاه میکروبی در زمینه بیماری، توسعه فناوریهای جدیدی که امکان آنالیز توان عملیاتی بالای(ظرف چند ساعت یا حتی دقیقه) وضعیت اجتماع میکروبی در سیستمهای پرورش میگو را فراهم میسازند، کاملا مهم است. یک نمونه دارای پتانسیل، رویکرد فلوسیتومتری است که به وسیلهی آن، نمونههای آب را میتوان ظرف چند دقیقه غربال کرد. اگرچه این رویکرد عمدتاً برای استفاده در سایر حوزهها مورد بررسی قرار گرفتهاست، اما به نظر میرسد که فلوسیتومتری ممکن است یک جایگزین را معرفی کند، اما روشی بسیار سریعتر نسبت به توالییابی ایلومینا برای تولید اطلاعات درخصوص پویایی زیستگاه میکروبی در سیستمهای آبزپروری است(پروپز و همکاران، 2016، 2018).
پایداری میکروبی بعنوان مفهوم اساسی در مدیریت میکروبی پایدار
علیرغم پیشرفتهایی که با توجه به عملکرد میکروبها در سیستمهای آبزیپروری رخ دادهاست، هنوز اطلاعات زیادی وجود دارد که باید کشف شود و برای دستیابی به مدیریت میکروبی بهینه به آنها نیاز است. با این وجود، در عین حال، صنعت توسعه را ادامه میدهد و تلاش میکند تا رویکردهای خاص خود برای پرداختن به مسائل بیماری که در این زمینه با آنها روبرو است را بیابد. اغلب اوقات، بهبودهایی در مبنای آزمون و خطا بدون درک واقعی از نحوه تاثیرگذاری اصلاحات بر محیط میکروبی درون سیستم پرورش انجام میشود. از این موارد، اطلاعات ارزشمند زیادی را میتوان استخراج کرد که ممکن است به درک این امر کمک کنند که چگونه میکروبها را میتوان در سیستمهای پرورش میگو مدیریت کرد.
یک نمونه، مفهوم جدید پرورش متراکم میگو با تعویض آب صفر است که با توالتهای میگو برای افزایش برداشت پسماند ادغام شدهاست. سیستمهای آبزیپروری گردشی در مراکز تکثیر و پرورش با فیلترهای زیستی چندبعدی، بهبود نتایج برحسب بقا، رشد و مقاومت میگو در برابر بیماری را رقم میزنند. همین امر برای پرورش میگو در استخر با پیکربندی مجدد استخرهای پرورش به شکل یک ماژول گردشی رخ میدهد، از جمله استخرهای استخراجی از پیش ذخیره شده با تیلاپیلا یا با علفهای دریایی گونه کائولرپا یا گراسیلاریا(شکل 8.10). سیستمهای فناوری بیوفلاک را میتوان در همین مقوله در نظر گرفت. گفته میشود که پاتوژن فرصتطلب وی.پاراهمولیتیکوس، بعنوان یک عامل علی AHPND، را کماکان میتوان در چنین سیستمهایی تشخیص داد، اما به آسانی به تراکمهای بحرانی برای بیان ویرولانس نمیرسد. لذا میتوان این فرضیه را طرح کرد که چنین سیستمهای یکپارچهای، یک محیط پایدار میکروبی را فراهم میسازند که منجر به احتمال کمتر دیسبیوزیس میشود.
اگرچه اصلاحات و تعدیلهایی که بر روی پیکربندیهای پرورش میگو در طی سالهای اخیر انجام شدهاست، الهام گرفته از دانش عمقی اکولوژی میکروبی نبودهاند، اما به نظر میرسد دارای این ویژگی مشترک هستند که به ایجاد پایداری میکروبی در سیستم در انطباق با نظریه اکولوژیکی کمک میکنند. بنابراین، مشاهدات صورت گرفته در این سیستمها به ما اجازه میدهند تا نظریه پایداری میکروبی را بیان کنیم که منجر به خطر بیماری کمتر میشود و در ترکیب با دانش علمی موجود، عناصر برای بهترین رویههای پرورش میگو را پیشنهاد میدهد، چنانچه در بخشهای زیر به آن پرداخته شدهاست. همانگونه که هیچ رویکردی نمیتواند تضمین کند که بیماری در سیستم پرورش شیوع نخواهد کرد، هدف نیز باید ایجاد موقعیتی باشد که خطر بیماری را به حداقل میرساند.
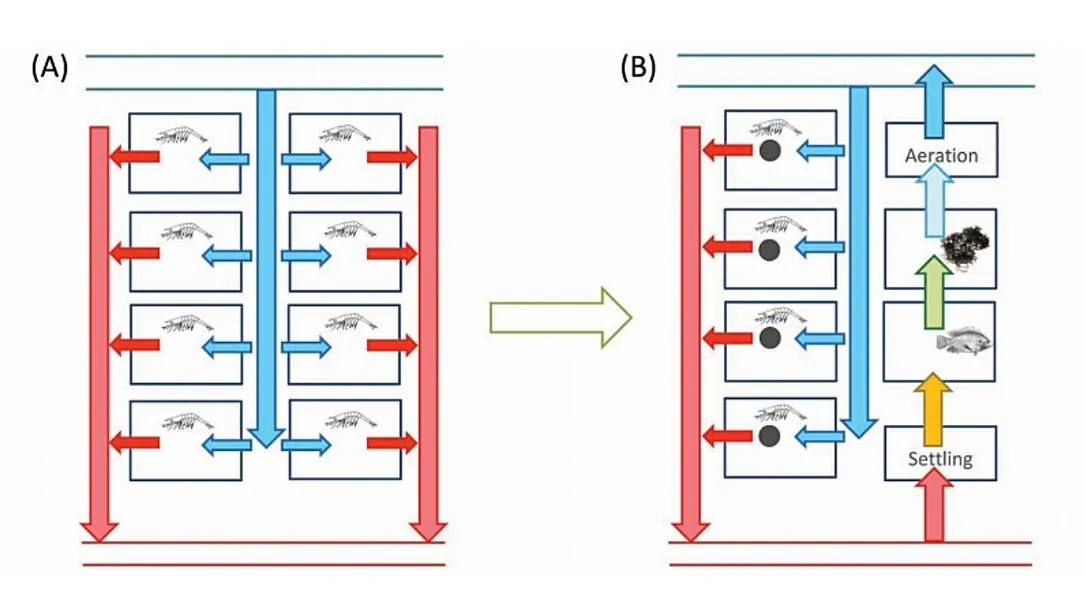 شکل 8.10. در طی سالها، پرورشدهندگان در آسیا شروع به تنظیم پیکربندی استخرهای میگوی خود برای مقابله با بیماری و به حداقل رساندن تاثیر محیطی کردند. در ابتدا، تمامی استخرها برای پرورش میگو به کار میرفتند و برای هر استخر آب با حالت جریان میانی تامین میشد(A). تنها برخی از استخرها برای پرورش میگو به کار میروند، و این استخرها دارای یک توالت میگو برای دفع پسماند مازاد در طی پرورش هستند. باقیمانده استخرها بعنوان استخرهای تصفیه مورد استفاده قرار میگیرند که از طریق آنها، آب قبل از استفاده مجدد یا تخلیه به گردش درمیآید(B). نتیجه این است که در سطح استخر، پرورش در سیستم گردشی انجام میشود.
شکل 8.10. در طی سالها، پرورشدهندگان در آسیا شروع به تنظیم پیکربندی استخرهای میگوی خود برای مقابله با بیماری و به حداقل رساندن تاثیر محیطی کردند. در ابتدا، تمامی استخرها برای پرورش میگو به کار میرفتند و برای هر استخر آب با حالت جریان میانی تامین میشد(A). تنها برخی از استخرها برای پرورش میگو به کار میروند، و این استخرها دارای یک توالت میگو برای دفع پسماند مازاد در طی پرورش هستند. باقیمانده استخرها بعنوان استخرهای تصفیه مورد استفاده قرار میگیرند که از طریق آنها، آب قبل از استفاده مجدد یا تخلیه به گردش درمیآید(B). نتیجه این است که در سطح استخر، پرورش در سیستم گردشی انجام میشود.
امنیت زیستی بعنوان نقطه شروع حیاتی برای مدیریت میکروبی کافی
ما هنوز مشغول کار بر روی جعبههای سیاه میکروبی در زمان پرورش میگو هستیم. به استثنای صفحهگذاری پراکنده ویبریوهای فرضی و کل باکتریهای هتروتروفیک، هیچ اطلاعاتی از اینکه کدام باکتریها و به چه تعداد وجود دارند، نداریم. در حقیقت، لازم نیست که از جزئیات این امر آگاه باشیم که کدام گروههای آرایهشناسی(یعنی نامها) وجود دارند؛ در عوض، باید از گروههای عملکردی آگاه باشیم(و برای کنترل آنها تلاش کنیم). در زمینه بیماری، باکتریهای موجود در سیستم را میتوان بصورت گسترده به سه گروه دستهبندی کرد(شکل 8.11) که دکتر لوک تران آنها را در طی صحبتهایش در کنفرانس آبزیپروری آسیا اقیانوسیه 2018، خوب، بد و زشت خواند.
- بد، پاتوژنهای اجباری هستند که نیازمند یک میزبان برای بقا هستند و لذا خطر بالایی را برای بیماری در زمان حضور در سیستم تحمیل میکنند.
- زشت، پاتوژنهای اجباری هستند که میتوانند مستقل از میزبان زنده بمانند و اعضای عادی اجتماع میکروبی در هر سیستم آبزیپروری هستند. آنها بسته به شرایط رایج مشکلآفرین میشوند، مثلاً کوئورومی که در آن حضور دارند، و لذا تعیین همبستگی کمی آنها با خطر بیماری دشوار است. آنها عوامل علی بیماریهای مرتبط با دیسبیوزیس هستند.
- خوب، باکتریهایی با فعالیت مفید یا خنثی هستند. اغلب اوقات، باکتریهای پروبیوتیک در این دسته جای میگیرند، اما به طور طبیعی باکتریهای رایج به این گروه تعلق دارند.
براساس دستهبندی بالا، درک این مطلب آسان است که یک موقعیت مطلوب وضعیتی است که در آن همواره از وجود پاتوژنهای اجباری اجتناب میشود، در حالی که سطوح پاتوژنهای فرصتطلب در طی پرورش میگو تا حد امکان پایین نگه داشته میشود تا خطر شیوع بیماری به حداقل برسد. بعنوان اولین خط از امنیت زیستی، شروع کار با ضدعفونیسازی آب ورودی و محیط پرورش(سطوح استخر و مخزن) برای حذف حداکثر پاتوژنهای اجباری و پاتوژنهای فرصتطلب از سیستمی که میگوها در آن ذخیره خواهند شد، بسیار حیاتی است. در ترکیب با سایر اقدامات امنیت زیستی سختگیرانه، مانند استفاده از میگوهای SPF، استفاده از محصولات و غذاهایی که بعنوان مواد عاری از پاتوژنها تایید شدهاند، استفاده از غذاهای زنده با فناوری خاص کنترل پاتوژن(مانند گونه ضد ویبریو کیستهای آرتمیا)، ضدعفونیسازی منظم تجهیزات مورد استفاده در سیستمهای پرورش و ضدعفونیسازی دستان و چکمههای کارگران، این تنها رویکرد برای به حداقل رساندن شانس ورود و تکثیر پاتوژنها(به خصوص پاتوژنهای اجباری) است.
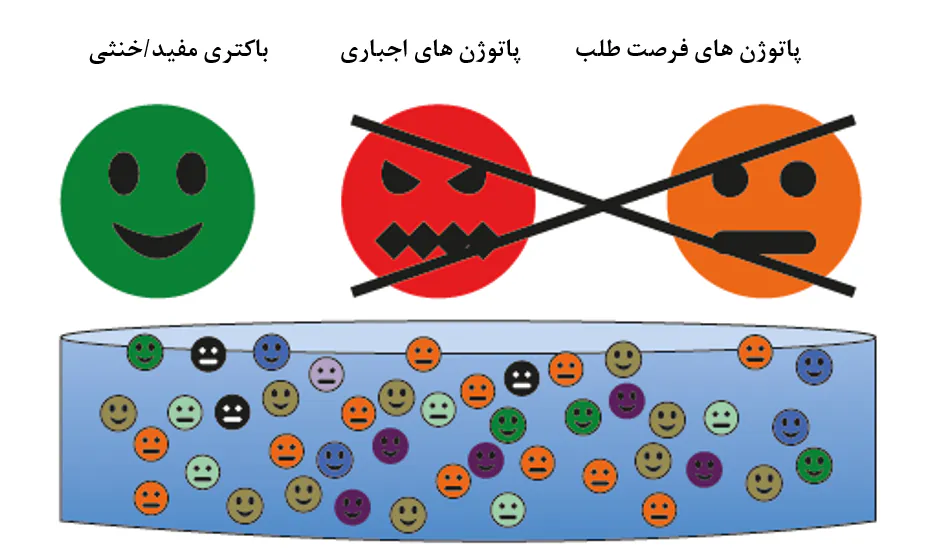 شکل 8.11. باکتریها در سیستمهای آبزیپروری شامل یک اجتماع میکروبی ترکیبی تصادفی هستند که در زمینه بیماری میتوان به سه دسته تفسیم کرد: باکتریهای مفید/خنثی، پاتوژنهای اجباری، و پاتوژنهای فرصتطلب. بدون نیاز به آگاهی از طبقهبندیهای آرایهشناسی واقعی، هدف نهایی مدیریت میکروبی شامل کاهش وجود گروههای پاتوژنی ضمن افزایش وجود گروه مفید برای به حداقل رساندن بیماری است.
شکل 8.11. باکتریها در سیستمهای آبزیپروری شامل یک اجتماع میکروبی ترکیبی تصادفی هستند که در زمینه بیماری میتوان به سه دسته تفسیم کرد: باکتریهای مفید/خنثی، پاتوژنهای اجباری، و پاتوژنهای فرصتطلب. بدون نیاز به آگاهی از طبقهبندیهای آرایهشناسی واقعی، هدف نهایی مدیریت میکروبی شامل کاهش وجود گروههای پاتوژنی ضمن افزایش وجود گروه مفید برای به حداقل رساندن بیماری است.
نظریه انتخاب R/K برای به حداقل رساندن دیسبیوزیس و بیماری
ضدعفونیسازی کامل میتواند میکروبهای ناخواسته را در آغاز پرورش از بین ببرد، اما میکروبهای مفید/خنثی را نیز حذف خواهد کرد. با این وجود، ضدعفونیسازی هرگز مطلق نیست، و امکان عملیات در واحد پرورش میگو به شیوهای استریل نیز وجود ندارد. ورود میگو با یک زیستگاه میکروبی روده موجود، ماهیت باز سیستم پرورش و وجود باکتریها در غذا(زنده) بصورت خودکار به ورود(مجدد) میکروبها در طی پرورش اشاره دارد. با این وجود، اگر ضدعفونیسازی و سایر اقدامات امنیت زیستی به اندازه کافی اجرا شوند، مشکلات مرتبط با پاتوژنهای اجباری(یعنی پاتوژنهایی که نیازمند یک میزبان برای تکثیر و بقا هستند) را میتوان به حداقل رساند. ماهیت غیراستریل سیستمهای پرورش میگو این تضمین را به همراه دارد که هم باکتریهای مفید/خنثی و هم باکتریهای فرصتطلب میتوانند دوباره در سیستم مستقر شوند. با این وجود، نحوهی توسعهی آنها نسبت به یکدیگر به رژیم انتخاب در سیستم و اختلاف در اکولوژی بین دو گروه بستگی دارد. یک تبیین کامل از این مطلب را میتوان در پژوهش وادستین و همکاران(2018) یافت. به طور خلاصه، پاتوژنهای فرصتطلب اغلب اوقات به گروه اکولوژیکی استراتژیستهای r(گونه ویبریو نمونههای معمولی از این هستند) تعلق دارند، به این معنا که آنها ماکزیمم نرخ رشد بالا[9] را نشان میدهند اما دارای توانایی رقابتی اندکی هستند. در نتیجه، آنها میتوانند به سرعت در محیطهایی تشکیل کلونی دهند که مواد مغذی فراوانی نسبت به تعداد باکتریهای موجود وجود دارد. در مقابل، باکتریهای مفید/خنثی اغلب به گروه استراتژیستهای K تعلق دارند. آنها ماکزیمم نرخ رشد پایینی را نشان میدهند و متخصصان رقابت هستند، یعنی دارای صفاتی هستند که آنها را در محیطهای دارای تراکمهای باکتریایی نزدیک به ظرفیت حامل[10] موفق میکند(یعنی، موجودی پایین مواد مغذی نسبت به تعداد باکتریها). باکتریهای استراتژیک r در اجتماعات به اصطلاح پیشگام غالب هستند، که اجتماعات باکتریایی ناپایداری هستند که ابتدا در محیطهای عاری از باکتری مستقر میشوند. باکتریهای استراتژیک K در جامعه به اصطلاح بالغ غالب هستند که اجتماعاتی با تابآوری بسیار بیشتر هستند که محیط را کنترل میکنند. ویژگیهای گونههای میکروبی استراتژیک r و K و اجتماعات پیشگام و بالغ در جدول 8.1 نشان داده شدهاند.
در یک موقعیت مطلوب، انتخاب r/K به نحوی در چنین سیستمهای آبزیپروری انجام میشود که در سطح خاص منجر به حضور حداقلی باکتریهای
استراتژیک r به علت ماهیت بالقوه مضر آنها میشود. در سطح اجتماع، یک اجتماع بالغ را هدف قرار میدهد، زیرا این کار پایداری را برحسب ترکیب میکروبی و قابلیت عملکرد به همراه دارد. اندکی پس از ضدعفونی کردن، زمانی که میگوها در سیستمها ذخیره میشوند، بار باکتریایی پایینی در ترکیب با موجودی بالای مواد مغذی حاصل از غذای خورده نشده، دفع مدفوع، میگوی مرده و … وجود دارد. تحت این شرایط، باکتریهای استراتژیک r خیلی سریع رشد میکنند و تعداد آنها منفجر خواهد شد. در عین حال، متخصصان رشد آرام و استراتژیک K نیز در محیط رشد میکنند، اما با نرخی بسیار کمتر. در نتیجه، چیرگی اولیهی باکتریهای استراتژیک r در محیط وجود دارد(شکل 8.12(A)) و چون پاتوژنهای فرصتطلب مانند ویبریوها به این گروه تعلق دارند، خطر بیشتری برای بیماری در میگوهای پرورشی ایجاد میشود. پیشبینی سطوح نسبی دقیق دو گروه از باکتریها در دوره پس از ضدعفونی کردن غیرممکن است، چون این باکتریها به شرایط در سیستم بستگی دارند که ظرفیت حامل باکتریایی و ویژگیهای رشد(مانند سطوح مغذی، نرخ تعویض آب، دما، شوری و …) را تعیین میکنند. با این وجود، با ضدعفونیسازی موفق و تامین نرمال ماده آلی، استراتژیستهای r ممکن است به آسانی بیش از 90 درصد اجتماع را به خود اختصاص دهند.
جدول 8.1. ویژگیهای گونههای باکتریایی استراتژیک r/K و اجتماعات پیشگام/بالغ(وادستین و همکاران، 2018)
| سطح گونه | استراتژیستهای r | استراتژیستهای K |
| ماکزیمم نرخ رشد | بالا | پایین |
| زیست توده در ظرفیت حامل | ناپایدار | پایدار |
| تاثیر غنیسازی/ناپایداری | رشد سریع | رشد آرام |
| توانایی رقابتی در تامین سرانه پایین زیرلایه | ضعیف | خوب |
| وابستگی به زیرلایه | پایین | بالا |
| سطح اجتماع | اجتماع پیشگام | اجتماع بالغ |
| کنترل بیولوژیکی | پایین | بالا |
| پایداری در مقابل اختلالات | ضعیف | خوب |
| تنوع(گونه، بیوشیمیایی) | پایین | بالا |
| عرض نیچ | وسیع | محدود |
| تخصصیسازی | پایین | بالا |
آن چیزی که برای دو گروه در بلند مدت رخ میدهد به نحوهی عملکرد سیستم بستگی دارد. برخی سیستمها از استقرار بلند مدت تعداد بالایی از باکتریهای استراتژیک r نسبت به استراتژیستهای K پشتیبانی میکنند. نمونههایی از چنین سیستمهایی سیستمهای جریان میانی با زمانهای کوتاه نگهداشت آب هستند که در آنها استراتژیستهای K همواره با شستشو خارج میشوند یا سیستمهایی بدون برداشت کافی پسماند هستند که منجر به نسبت همواره بالای زیرلایه به باکتریها میشود(شکل 8.12(B)). معمولاً چنین سیستمهایی هستند که ذاتاً از خطر بالاتر بیماری رنج میبرند، زیرا اجتماع میکروبی تحت تسلط باکتریهای ناپایدار استراتژیست r قرار دارند. چنین سیستمهای شامل اجتماعات پیشگاه نابالغ میکروبی هستند. سایر سیستمها از تسلط باکتریهای استراتژیک K حمایت میکنند. این سیستمها، برای مثال، شامل سیستمهای تعویض آب حداقلی و استفاده از اقدامات برای به حداقل رساندن بار پسماند هستند که یک نسبت پایی زیرلایه به باکتری را تضمین میکنند(شکل 8.12(C)). در چنین سیستمهایی، جمعیتهای استراتژیک r توسط باکتریهای استراتژیک K با رقابت از سیستم خارج میشوند. این امر یک اجتماع بالغ پایدار میکروبی را شکل میدهد که حساسیت کمتری به شرایط محیطی متغیر دارد و لذا مقاومت بیشتری در مقابل دیسبیوزیس از خود نشان میدهد.
اغلب اوقات بدون درک پیامدها در سطح میکروبی، رویکردهای جدید پرورش یکپارچه میگو یا پرورش میگو در سیستمهای گردشی، پایداری میکروبی را با انتخاب K ارتقا میدهند و مقاومت بیشتری در مقابل دیسبیوزیس ایجاد میکنند. با این وجود، تمامی پرورشدهندگان قادر به تنظیم طراحی سیستم خود برای به حداقل رساندن خطر بیماری به وسیله انتخاب K میکروبی نیستند. همانگونه که پیش از این در همین فصل ذکر شد، پروبیوتیکها اغلب اوقات برای کنترل تسلط پاتوژنهای فرصتطلب به کار میروند، هرچند همیشه مشخص نیست که دقیقاً تا چه اندازه آنها در محیط میکروبی مداخله میکنند. میتوان فرض کرد که پروبیوتیکها ماهیتاً برای حیوانات پرورش یافته، مفید یا حداقل خنثی هستند. در این صورت، آنها را میتوان بخشی از میکروبهای خواستهشده تلقی کرد. بسته به اکولوژی آنها(نرخ رشد، توانایی رقابتی، و تخصصیسازی)، پروبیوتیکها میتوانند به گروه استراتژیک r یا استراتژیک K تعلق داشتهباشند. زمانی که عمدتاً ویژگیهای استراتژیک K نشان داده میشود، افزودن پروبیوتیکها میتواند این گروه را از آغاز تقویت کند و به بهبود نسبت زیرلایه به باکتریها کمک کند. از نقطه نظر اکولوژیکی، این امر باید منجر به گردش سریعتر به یک اجتماع میکروبی بالغ شود. موفقیت در استقرار و فراوانی کاربرد، کماکان به طراحی سیستم بستگی داد. باوجود این، پروبیوتیکها اغلب برای نرخ رشد بالای خود انتخاب میشوند؛ به این معنا که آنها اغلب ویژگیهایی از استراتژیستهای r را نشان میدهند. در این صورت، کاربرد آنها سودمند است، زیرا به اوج اولیهی استراتژیستهای r در سیستم کمک میکنند و بدینوسیله زیرلایه از دسترس پاتوژنهای فرصتطلب بالقوه خطرناک که نمیتوانند به خوبی در سیستم رشد کنند، دور نگه میدارند. یا به بیان دیگر، اوج استراتژیستهای r کماکان وجود خواهد داشت، اما حداقل تاحدودی شامل باکتریهای پروبیوتیک با ویژگیهای مفید یا خنثی شناخته شده برای حیوانات هستند، در حالی که برای جانشینی یک اجتماع بالغ مفید آماده میشود(اگر سیستم اجازه دهد).
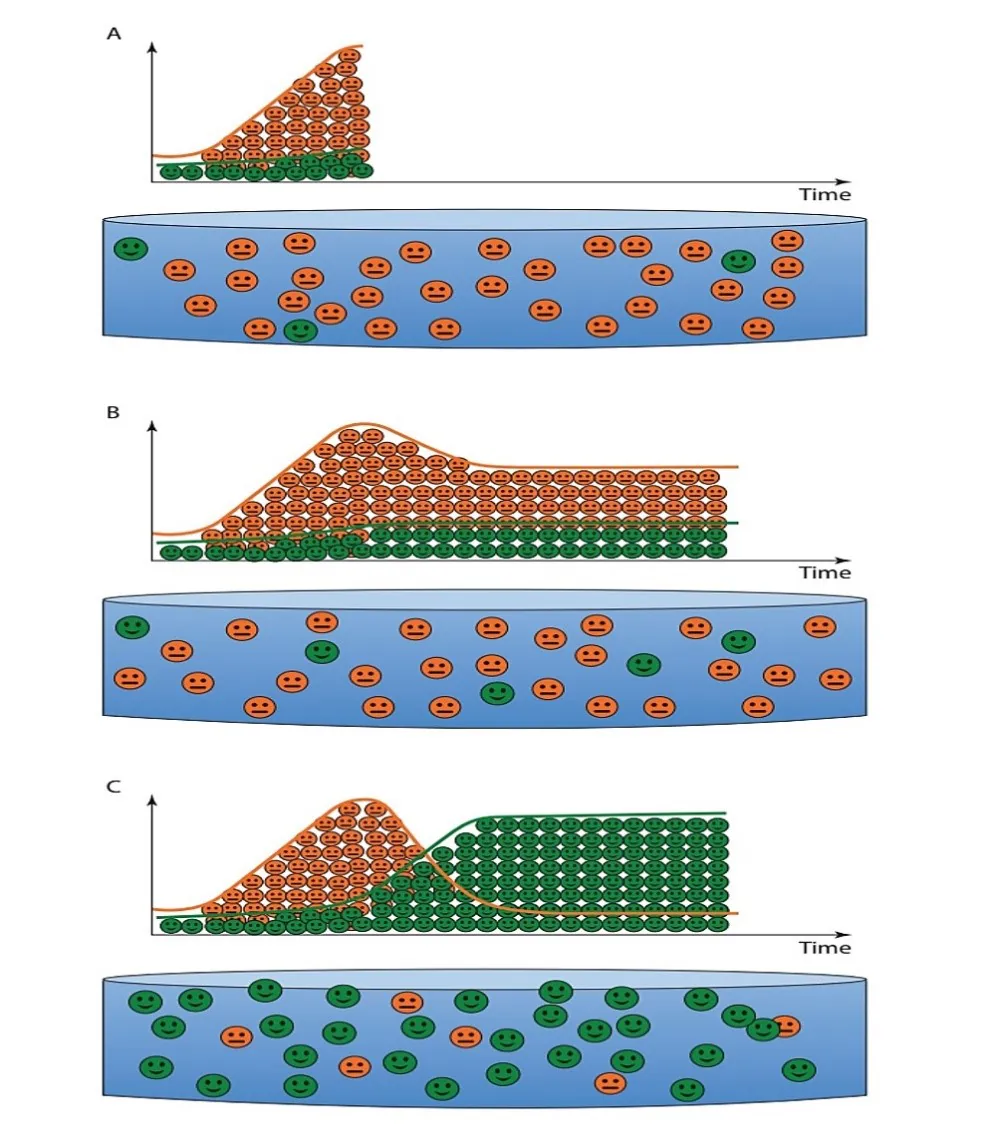 شکل 8.12. (A) اندکی پس از ضدعفونی کردن و ورود میگو در سیستم، یک اصل انتخاب اکولوژیکی فعال وجود دارد که منجر به افزایش خطر تسلط باکتریهای استراتژیک r (نمادهای نارنجی) که اغلب پاتوژنهای فرصت طلب هستند بر باکتریهای استراتژیک K (نمادهای سبز) میشود. اجتماع میکروبی را میتوان بعنوان یک اجتماع پیشگام ناپایدار توصیف کرد. در این مرحله، افزایش خطر بیماری وجود دارد. (B) سیستمهایی که اجازه نسبت بالای زیرلایه به باکتریها را میدهند یا شرایط محیطی ناپایدار را رقم میزنند(برداشت پسماند حداقلی) امکان تسلط مستمر یا حداقل حضور بالای پاتوژنهای بالقوه فرصتطلب در سیستم را فراهم میسازند. علیرغم اینکه باکتریهای مفید/خنثی قادر به رشد هستند، اما اینها معمولاً سیستمهایی با یک اجتماع پیشگام باقیمانده هستند که تحت خطر بالای دائمی دیسبیوزیس و شیوع بیماری قرار داند. (C) سایر سیستمهایی که یک نسبت حداقلی زیرلایه به باکتریها و شرایط محیطی پایدار(تعویض آب صفر، برداشت پسماند) را تضمین میکنند، منجر به تسلط باکتریهای مفید/خنثی میشوند، در حالی که باکتریهای دارای اکولوژی پاتوژنهای فرصتطلب سرکوب میشوند. در این سیستمها، یک اجتماع میکروبی بالغ میتواند شکل بگیرد که منجر به خطر ذاتی بسیار کمتری از دیسبیوزیس و بیماری میشود.
شکل 8.12. (A) اندکی پس از ضدعفونی کردن و ورود میگو در سیستم، یک اصل انتخاب اکولوژیکی فعال وجود دارد که منجر به افزایش خطر تسلط باکتریهای استراتژیک r (نمادهای نارنجی) که اغلب پاتوژنهای فرصت طلب هستند بر باکتریهای استراتژیک K (نمادهای سبز) میشود. اجتماع میکروبی را میتوان بعنوان یک اجتماع پیشگام ناپایدار توصیف کرد. در این مرحله، افزایش خطر بیماری وجود دارد. (B) سیستمهایی که اجازه نسبت بالای زیرلایه به باکتریها را میدهند یا شرایط محیطی ناپایدار را رقم میزنند(برداشت پسماند حداقلی) امکان تسلط مستمر یا حداقل حضور بالای پاتوژنهای بالقوه فرصتطلب در سیستم را فراهم میسازند. علیرغم اینکه باکتریهای مفید/خنثی قادر به رشد هستند، اما اینها معمولاً سیستمهایی با یک اجتماع پیشگام باقیمانده هستند که تحت خطر بالای دائمی دیسبیوزیس و شیوع بیماری قرار داند. (C) سایر سیستمهایی که یک نسبت حداقلی زیرلایه به باکتریها و شرایط محیطی پایدار(تعویض آب صفر، برداشت پسماند) را تضمین میکنند، منجر به تسلط باکتریهای مفید/خنثی میشوند، در حالی که باکتریهای دارای اکولوژی پاتوژنهای فرصتطلب سرکوب میشوند. در این سیستمها، یک اجتماع میکروبی بالغ میتواند شکل بگیرد که منجر به خطر ذاتی بسیار کمتری از دیسبیوزیس و بیماری میشود.
نتیجهگیری
در این فصل، ما به دنبال اثبات این امر بودهایم که دانش جدید درخصوص حضور و فعالیت گروههای باکتریایی در آب و روده میگوهای پرورشی امکان تعیین بهتر چارچوب مشاهدات تجربی مرگهای غیرقابل توضیح در مراکز تکثیر میگو و سیستمهای رشد باز را فراهم میسازد. رویکرد کنونی در تمرکز بر روشهای سرکوبگرانه به تنهایی برای کنترل پاتوژنها در سیستمهای آبزیپروری بهترین راه برای به حداقل رساندن خطر بیماری پاتوژنی نیستند. اغلب، کاهش غیرگزینشی باکتریهای ناخواسته از طریق ضدعفونیسازی منجر به ترویج باکتریهای استراتژیست r میشود؛ یعنی گروهی اکولوژیکی که شامل پاتوژنهای فرصتطلب فراوانی است. یک نمونه معمولی ویبریوها هستند که ویرولانس آنها بصورت تابعی از تراکم جمعیت بسته به پدیده کوئوروم سنسینگ روشن میشود. ما به صنعت توصیه میکنیم که رژیمهای انتخاب میکروبی را وضع نماید که به تعادل در زیستگاه میکروبیهای r/K در سیستمهای پرورش برای به حداقل رساندن شانس استقرار باکتریهای مرتبط با بیماری ختم میشوند. علاوه بر این، هم محیط آکادمیک و هم صنعت باید تحقیقاتی را با همکاری یکدیگر برای تنظیم بهتر و توسعهی پروتکلهای مدیریت میکروبی مقرون به صرفه انجام دهند. در هر صورت، بدیهی است که یک رویکرد اکولوژیکیتر برای کنترل بیماری بیش از گذشته در پرورش میگو در آینده اجرا خواهد شد.
میکروبها و فعالیتهای آنها اثرات فراگیر، عمیق و عموماً مثبتی بر عملکرد، سلامت و رفاه موجودات بشری، کل جهان بیولوژیکی و در حقیقت کل سطح سیاره زمین و جو آن دارند.
منابع و مراجع
Ackefors, H. (2009) Te evolution of a worldwide shrimp industry. World Aquaculture 40(3), 46–55. Anderson J.L., Valderrama, D., and Jory, D. (2019) GOAL 2019 Shrimp Review. GOAL Conference, Chennai, India. Balcázar, J.L., de Blas, I., Ruiz-Zarzuela, I., Cunningham, D. Vendrell, D., and Múzquiz, J.L. (2006) Te role of
probiotics in aquaculture. Veterinary Microbiology 114, 173–186. Bass, D., Stentiford, G.D., Wang, H.-C., Koskella, B., and Tyler, C.R. (2019) Te pathobiome in animal and plant
diseases. Trends in Ecology and Evolution 34, 996–1008. Bratvold, D., Lu, J., and Browdy, C.L. (1999) Disinfection, microbial community establishment and shrimp production
in a prototype biosecure pond. Journal of the World Aquaculture Society 30, 422–432. Burns, A.R., Miller, E., Agarwal, M., Rolig, A.S., Milligan-Myhre, K., Seredick, S., Guillemin, K., and Bohannan, B.J.M. (2017) Interhost dispersal alters microbiome assembly and can overwhelm host innate immunity in an experimental zebrafsh model. Proceedings of the National Academy of Sciences, USA 114, 11181–11186. Chen, W.-Y., Ng, T.H., Wu, J.-H., Chen, J.-W., and Wang, H.-C. (2017) Microbiome dynamics in a shrimp رشد باز pond with possible outbreak of acute hepatopancreatic necrosis disease. Scientifc Reports 7, 9395. Choudhury, T.G., Nagaraju, V.T., Gita, S., Paria, A., and Parhi, J. (2017) Advances in bacteriophage research for bacterial disease control in aquaculture. Reviews in Fisheries Science & Aquaculture 25, 113–125.
Cornejo-Granados, F., Gallardo-Becerra, L., Leonardo-Reza, M., Ochoa-Romo, J.P., and Ochoa-Leyva, A. (2018) A meta-analysis reveals the environmental and host factors shaping the structure and function of the shrimp microbiota. PeerJ 6, e5382.
Cornejo-Granados, F., Lopez-Zavala, A.A., Gallardo-Becerra, L., Mendoza-Vargas, A., Sánchez, F., Vichido, R., Brieba, L.G., Viana, M.T., Sotelo-Mundo, R.R., and Ochoa-Leyva, A. (2017) Microbiome of Pacifc Whiteleg shrimp reveals diferential bacterial community composition between Wild, aquacultured and AHPND/EMS outbreak conditions. Scientifc Reports 7, 11783.
Dai, W., Chen, J., and Xiong, J. (2018) Concept of microbial gatekeepers: positive guys? Applied Microbiology and Biotechnology 103, 633–641.
Dash, P., Avunje, S., Tandel, R.S., Sandeep, K.P., and Panigrahi, A. (2017) Biocontrol of luminous vibriosis in shrimp aquaculture: a review of current approaches and future prospects. Reviews in Fisheries Science and Aquaculture 25, 245–255.
Defoirdt, T. (2018) Quorum-sensing systems as targets for antivirulence therapy. Trends in Microbiology 26, 313–328.
Defoirdt, T., Benneche, T., Brackman, G., Coenye, T., Sorgeloos, P., and Scheie, A.A. (2012) A quorum sensing-disrupting brominated thiophenone with a promising therapeutic potential to treat luminescent vibriosis. PloS ONE 7, e41788.
Defoirdt, T., Boon, N., Sorgeloos, P., Verstraete, W., and Bossier, P. (2007) Alternatives to antibiotics to control bacterial infections: luminescent vibriosis in aquaculture as an example. Trends in Biotechnology 25, 472–479.
Defoirdt, T., Crab, R., Wood, T.K., Sorgeloos, P., Verstraete, W., and Bossier, P. (2006) Quorum sensing-disrupting brominated furanones protect the gnotobiotic brine shrimp Artemia franciscana from pathogenic Vibrio harveyi, Vibrio campbellii and Vibrio parahaemolyticus isolates. Applied and Environmental Microbiology 72, 6419–6423.
Defoirdt, T., Ruwandeepika, H.A.D., Karunasagar, I., Boon, N., and Bossier, P. (2010) Quorum sensing negatively regulates chitinase in Vibrio harveyi. Environmental Microbiology Reports 2, 44–49.
Defoirdt, T. and Sorgeloos, P. (2012) Monitoring of Vibrio harveyi quorum sensing activity in real time during infection of brine shrimp larvae. ISME Journal 6, 2314–2319.
Defoirdt, T., Sorgeloos, P., and Bossier, P. (2011a) Alternatives to antibiotics for the control of bacterial disease in aquaculture. Current Opinion in Microbiology 14, 251–258.
Defoirdt, T., Tanh, L.D., Van Delsen, B., De Schryver, P., Sorgeloos, P., Boon, N. and Bossier, P. (2011b). N-acylhomoserine lactone-degrading Bacillus strains isolated from aquaculture animals. Aquaculture 311, 258–260.
De Schryver, P., Defoirdt, T., and Sorgeloos, P. (2014) Early mortality syndrome outbreaks: a microbial management issue in shrimp farming? PloS Pathogens 10, e1003919.
De Schryver, P. and Vadstein, O. (2014) Ecological theory as a foundation to control pathogenic invasion in aquaculture. ISME Journal 8, 2360–2368.
Dhar, A. (2019) Diseases in shrimp aquaculture – Possible remedial pathways. Asia Pacifc Aquaculture 2019 Conference, Chennai, India.
Dickey, S.W., Cheung, G.Y.C., and Otto, M. (2017) Diferent drugs for bad bugs: antivirulence strategies in the age of antibiotic resistance. Nature Reviews Drug Discovery 16, 457–471.
Dobretsov, S., Teplitski, M., Alagely, A., Gunasekera, S.P., and Paul, V.J. (2010) Malyngolide from the cyanobacterium Lyngbya ignaling interferes with quorum sensing circuitry. Environmental Microbiology Reports 2, 739–744. Dong, Y.H., Gusti, A.R., Zhang, Q., Xu, J.L., and Zhang, L.H. (2002) Identifcation of quorum-quenching N-acyl
homoserine lactonases from Bacillus species. Applied and Environmental Microbiology 68, 1754–1759. Dong, Y.H., Wang, L.H., and Zhang, L.H. (2007) Quorum-quenching microbial infections: mechanisms and implications. Philosophical Transactions of the Royal Society B 36, 1201–1211.
Fan, J., Chen, L., Mai, G., Zhang, H., Yang, J., Deng, D., and Ma, Y. (2019) Dynamics of the gut microbiota in developmental stages of Litopenaeus vannamei reveal its association with body weight. Scientifc Reports 9, 734.
FAO (2000) Te state of world aquaculture and ignaling 2000. Part I: World review of ignaling and aquaculture. Food and Agriculture Organization of the United Nations, Rome, Italy.
FAO/NACA (2012) R.P. Subasinghe, J.R. Arthur, D.M. Bartley, S.S. De Silva, M. Halwart, N. Hishamunda, C.V. Mohan & P. Sorgeloos (eds) Farming the Waters for People and Food. Proceedings of the Global Conference on Aquaculture 2010, Phuket, Tailand, 22–25 September 2010. FAO, Rome, Italy and NACA, Bangkok, Tailand.
Gatesoupe, F. J. (1991) Te Use of Probiotics in Fish Hatcheries: Results and Prospect. ICES Mariculture Committee report F.4–7. ICES, Copenhagen, Denmark.
Gatesoupe, F. J. (1999) Te use of probiotics in aquaculture. Aquaculture 180, 147–165.
Grover, S., Rashmi, H.M., Srivastava, A.K., and Kumar, V. (2012) Probiotics for human health – new innovations and emerging trends. Gut Pathogens 4, 15.
Henke, J.M. and Bassler, B.L. (2004) Quorum sensing regulates type III secretion in Vibrio harveyi and Vibrio parahaemolyticus. Journal of Bacteriology 186, 3794–3805.
Hoseinifar, S.H., Sun, Y.-Z., Wang A., and Zhou, Z. (2018) Probiotics as means of diseases control in aquaculture, a review of current knowledge and future perspectives. Frontiers in Microbiology 9, 2429.
Hou, D., Huang, Z., Zeng, S., Liu, J., Weng, S., and He, J. (2018) Comparative analysis of the bacterial community compositions of the shrimp intestine, surrounding water and sediment. Journal of Applied Microbiology 125, 792–799.
Hou, D., Zeng, S., Liu, J., Yan, M., Weng, S., He, J., and Huang, Z. (2016) Characterization of prokaryotic and eukaryotic microbial community in Pacifc white shrimp ponds. Journal of Aquaculture Research and Development 7, 12.
Huang, Z., Li, X., Wang, L., and Shao, Z. (2014) Changes in the intestinal bacterial community during the growth of white shrimp, Litopenaeus vannamei. Aquaculture Research 47, 1737–1746.
Irianto, A. and Austin, B. (2002) Use of probiotics to control furunculosis in rainbow trout, Oncorhynchus mykiss (Walbaum). Journal of Fish Diseases 25, 333–342.
Janssens, J.C.A., De Keersmaecker, S.C.K., De Vos, D.E., and Vanderleyden, J. (2008) Small molecules for interference with cell-cell communication systems in Gram-negative bacteria. Current Medicinal Chemistry 15, 2144–2156.
Jamal, M.T., Abulrahman, I.A., Harbi, M.A., and Chithambaran, S. (2019) Probiotics as alternative control measures in shrimp aquaculture: a review. Journal of Applied Biology and Biotechnology 7, 69–77.
Karunasagar, I., Karunasagar, I., and Umesha, R.K. (2014) Microbial diseases in shrimp aquaculture. In: Ramaiah, N. (ed.) Marine Microbiology: Facets & Opportunities. National Institute of Oceanography, Goa, India, pp. 121–134.
Kautsky, N., Rönnbäcka, P., Tedengren, M., and Troell, M. (2000) Ecosystem perspectives on management of disease in shrimp pond farming. Aquaculture 191, 145–161.
Kumar, T.S., Vidya, R., Kumar, S., Alavandi, S.V., and Vijayan, K.K. (2017) Zoea-2 syndrome of Penaeus vannamei in shrimp hatcheries. Aquaculture 479, 759–767.
Landsman, A., St-Pierre, B., Rosales-Leija, M., Brown, M., and Gibbons, W. (2019) Impact of aquaculture practices on intestinal bacterial profles of Pacifc whiteleg shrimp Litopenaeus vannamei. Microorganism 7, 93.
Lavilla-Pitogo, C.R., Leaňo, E.M., and Paner, M.G. (1998) Mortalities of pond-cultured juvenile shrimp, Penaeus monodon, associated with dominance of luminescent vibrios in the rearing environment. Aquaculture 164, 337–349.
Li, E., Xu, C., Wang, X., Wang, S., Zhao, Q., Zhang, M., Qin, J.G., and Chen, L. (2018) Gut microbiota and its modulation for healthy farming of Pacifc white shrimp Litopenaeus vannamei. Reviews in Fisheries Science & Aquaculture 26, 381–399.
Loomis, I. (2018) Te unmet promise of pondside PCR. Global Aquaculture Advocate, 20 August 2018. Available at: https://www.aquaculturealliance.org/advocate/unmet-promise-pondside-pcr (accessed 30 July 2021).
Marques, A., Ollevier, F., Verstraete, W., Sorgeloos, P., and Bossier, P. (2006) Gnotobiotically grown aquatic animals: opportunities to investigate host–microbe interactions. Journal of Applied Microbiology 100, 903–918.
Mayes, T. (2018) 18% increase in shrimp production predicted. Te Fish Site, 28 September 2018. Available at: https:// thefshsite.com/articles/18-increase-in-shrimp-production-predicted (accessed 30 July 2021).
Miranda-Baeza, A., Nolasco-López, M., Rivas-Vega, M.E., Huerta-Rábago, J.A., Martínez‐Córdova, L.R., and Martínez‐Porchas, M. (2020) Short‐term ignal of the inoculation of probiotics in mature biofocs: Water quality parameters and abundance of heterotrophic and ammonia‐oxidizing bacteria. Aquaculture Research 51, 255–264.
Mok, K.C., Wingreen, N.S., and Bassler, B.L. (2003) Vibrio harveyi quorum sensing: a coincidence detector for two autoinducers controls gene expression. EMBO Journal 22, 870–881.
Natrah, F.M.I., Alam, M.I., Pawar, S., Harzevili, A.S., Nevejan, N., Boon, N., Sorgeloos, P., Bossier, P., and Defoirdt,
- (2012) Te impact of quorum sensing on the virulence of Aeromonas hydrophila and Aeromonas salmonicida towards burbot (Lota lota L.) larvae. Veterinary Microbiology 159, 77–82. Natrah, F.M.I., Ruwandeepika, H.A.D., Pawar, S., Karunasagar, I., Sorgeloos, P., Bossier, P., and Defoirdt, T. (2011) Regulation of virulence factors by quorum sensing in Vibrio harveyi. Veterinary Microbiology 154, 124–129. Ninawe, A.S. and Selvin, J. (2009) Probiotics in shrimp aquaculture: avenues and challenges. Critical Reviews in Microbiology 35, 43–66.
Noor, N.M., Defoirdt, T., Alipiah, N., Karim, M., Daud, H., and Natrah, I. (2019) Quorum sensing is required for full virulence of Vibrio campbellii towards tiger grouper (Epinephelus fuscoguttatus) larvae. Journal of Fish Diseases 42, 489–495.
Pande, G.S.J., Aamdal Scheie, A., Benneche, T., Wille M., Sorgeloos P., Bossier P., and Defoirdt T. (2013a) Quorum sensing-disrupting compounds protect larvae of the giant freshwater prawn Macrobrachium rosenbergii from Vibrio harveyi infection. Aquaculture 406–407, 121–124.
Pande, G.S.J., Natrah, F.M., Flandez, A.V., Kumar, U., Niu, Y., Bossier, P., and Defoirdt, T. (2015) Isolation of AHL-degrading bacteria from micro-algal cultures and their impact on algal growth and on virulence of Vibrio campbellii to prawn larvae. Applied Microbiology and Biotechnology 99, 10805–10813.
Pande, G.S.J., Natrah, F.M.I., Sorgeloos, P., Bossier, P., and Defoirdt, T. (2013b) Te Vibrio harveyi quorum sensing signals have a diferent impact on virulence of the bacterium towards diferent crustacean hosts. Veterinary Microbiology 167, 540–545.
Props, R., Monsieurs, P., Mysara, M., Clement, L., and Boon, N. (2016) Measuring the biodiversity of microbial communities by fow cytometry. Methods in Ecology and Evolution 7, 1376–1385.
Props, R., Rubbens, P., Besmer, M., Buysschaert, B., Sigrist, J., Weilenmann, H., Waegeman, W., Boon, N., and Hammes, F. (2018) Detection of microbial disturbances in a drinking water microbial community through continuous acquisition and advanced analysis of fow cytometry data. Water Research 145, 73–82.
Ramanchandran, K. (2017) Present status and prospect trends of probiotics in shrimp aquaculture. Journal of Fisheries Sciences 11, 71–73.
Santhakumari, S., Jayakumar R., Logalakshmi, R., Prabhu, N.M., Abdul Nazar, A.K., Karutha Pandian, S., and Veera Ravi, A. (2018) In vitro and in vivo ignal of 2,6-di-tert-butyl-4-methylphenol as an antibioflm agent against quorum sensing mediated bioflm formation in Vibrio spp. International Journal of Food Microbiology 281, 60–71.
Santos, L. and Ramos, F. (2018) Antimicrobial resistance in aquaculture: current knowledge and alternatives to tackle the problem. International Journal of Antimicrobial Agents 52, 135–143.
Saurav, K., Costantino, V., Venturi, V., and Steindler, L. (2017) Quorum sensing inhibitors from the sea discovered using bacterial N-acyl-homoserine lactone-based biosensors. Marine Drugs 15, 53.
Seibert, C.H. and Pinto, A.R. (2012) Challenges in shrimp aquaculture due to viral diseases: distribution and biology of the fve major penaeid viruses and interventions to avoid viral incidence and dispersion. Brazilian Journal of Aquaculture 43, 857–864.
Soltani, M., Ghosh, K., Hoseinifar, S.H., Kumar, V., Lymbery, A.J., Roy, S., and Ringø, E. (2019) Genus Bacillus, promising probiotics in aquaculture: aquatic animal origin, bio-active components, bioremediation and efcacy in fsh and ignaling. Reviews in Fisheries Science and Aquaculture 27, 1–49.
Sorgeloos, P. (2013) Aquaculture: the blue biotechnology of the future. World Aquaculture 44(3), 18–27.
Sotomayor, M.A., Reyes, J.K., Restrepo, L., Dominguez-Borbor, C., Maldonado, M., and Bayot, B. (2019) Efcacy assessment of commercially available natural products and antibiotics, commonly used for mitigation of pathogenic Vibrio outbreaks in Ecuadorian Penaeus (Litopenaeus) vannamei hatcheries. PloS One 14, e0210478.
Taw, N. (2017) A look at various intensive shrimp farming systems in Asia. Global Aquaculture Advocate, 24 July 2017. Available at: https://www.aquaculturealliance.org/advocate/intensive-shrimp-farming-asia/ (accessed 30 July 2021)
Teasdale, M.E., Liu, J., Wallace, J., Akhlaghi, F., and Rowley, D.C. (2009) Secondary metabolites produced by the marine bacterium Halobacillus salinus that inhibit quorum sensing-controlled phenotypes in Gram-negative bacteria. Applied and Environmental Microbiology 75, 567–572.
Titamadee, S., Prachumwat, A., Srisala, J., Jaroenlak, P., Salachan, P., Sritunyalucksana, K., Flegel, T.W., and Itsathitphaisarn, O. (2016) Review of current disease threats for cultivated penaeid shrimp in Asia. Aquaculture 452, 69–87.
Timmis, K., Cavicchioli, R., Garcia, J.L., Nogales, B., Chavarría, M., Stein, L., McGenity, T.J., Webster, N., Singh, B.K., Handelsman, J., de Lorenzo, V., Pruzzo, C., Timmis, J., Martín, J.L.M., Verstraete, W., Jetten, M., Danchin, A., Huang, W., Gilbert, J., Lal, R., Santos, H., Lee, S.Y., Sessitsch, A., Bonfante, P., Gram, L., Lin, R.T.P., Ron, E., Karahan, Z.C., van der Meer, J.R., Artunkal, S., Jahn, D., and Harper, L. (2019) Te urgent need for microbiology literacy in society. Environmental Microbiology 21, 1513–1528.
Torres, M., Dessaux, Y., and Llamas, I. (2019) Saline environments as a source of potential quorum sensing disruptors to control bacterial infections: a review. Marine Drugs 17, 191.
Vadstein, O., Attramadal, K.J.K., Bakke, I., Forberg, T., Olsen, Y., Verdegem, M, Giatsis, C., Skjermo, J., Aasen, I.M., Gatesoupe, F.-J., Dierckens, K., Sorgeloos, P., and Bossier, P. (2018a) Managing the microbial community of marine fsh larvae: a holistic perspective for larviculture. Frontiers in Microbiology 9, 1820.
Vadstein, O., Attramadal, K.J.K., Bakke, I., and Olsen, Y. (2018b) K-selection as microbial community management strategy: a method for improved viability of larvae in aquaculture. Frontiers in Microbiology 9, 2730.
Vandenberghe, J., Verdonck, L., Robles-Arozarena, R., Rivera, G., Bolland, A., Balladares, M., Gomez-Gil, B., Calderon, J., Sorgeloos, P., and Swings, J. (1999) Vibrios associated with Litopenaeus vannamei larvae, postlarvae, broodstock, and hatchery probionts. Applied and Environmental Microbiology 65, 2592–2597.
Van Hai, N. and Fotedar, R. (2010) A review of probiotics in shrimp aquaculture. Journal of Applied Aquaculture 22, 251–266.
Verschuere, L., Rombaut, G., Sorgeloos, P., and Verstraete, W. (2000) Probiotic bacteria as biological control agents in aquaculture. Microbiology and Molecular Biology Reviews 64, 655–671.
Walker, P.J. and Mohan, C.V. (2009) Viral disease emergence in shrimp aquaculture: origins, impact and the ignalingess of health management strategies. Reviews in Aquaculture 1, 125–154.
Xiao, J., Liu, L., Ke, Y., Li, X., Liu, Y., Pan, Y., Yan, S., and Wang, Y. (2017) Shrimp AHPND-causing plasmids encoding the PirAB toxins as mediated by pirAB-Tn903 are prevalent in various Vibrio species. Scientifc Reports 7, 42177.
Xiong, J. (2018) Progress in the gut microbiota in exploring shrimp disease pathogenesis and incidence. Applied Microbiology and Biotechnology 102, 7343–7350.
Xiong, J., Dai, W., and Li, C. (2016) Advances, challenges, and directions in shrimp disease control: the guidelines from an ecological perspective. Applied Microbiology and Biotechnology 100, 6947–6954.
Xiong, J., Dai, W., Qiu, Q., Zhu, J., Yang, W., and Li, C. (2018) Response of host–bacterial colonization in shrimp to developmental stage, environment and disease. Molecular Ecology 27, 3686–3699.
Xiong, J., Nie, L., and Chen, J. (2019a) Current understanding on the roles of gut microbiota in fsh disease and immunity. Zoological Research 18, 70–76.
Xiong, J., Wang, K., Wu, J., Qiuqian, L., Yang, K, Qian, Y., and Zhang, D. (2015) Changes in intestinal bacterial communities are closely associated with shrimp disease severity. Applied Microbiology and Biotechnology 99, 6911–6919.
Xiong, J., Xuan, L., Yu, W., Zhu, J., Qiu, Q., and Chen, J. (2019b) Spatiotemporal successions of shrimp gut microbial colonization: high consistency despite distinct species pool. Environmental Microbiology 21, 1383–1394.
Xiong, J., Zhu, J., Dai, W., Dong, C., Qiu, Q., and Li, C. (2017) Integrating gut microbiota immaturity and disease-discriminatory taxa to diagnose the initiation and severity of shrimp disease. Environmental Microbiology 19, 1490–1501.
Xiong, J., Zhu, J., Wang, K., Wang, X., Ye, X., Liu, L., Zhao, Q., Hou, M., Qiuqian, L., and Zhang, D. (2014a) Te temporal scaling of bacterioplankton composition: high turnover and predictability during shrimp cultivation. Microbial Ecology 67, 256–264.
Xiong, J., Zhu, J., and Zhang, D. (2014b) Te application of bacterial indicator phylotypes to predict shrimp health status. Applied Microbiology and Biotechnology 98, 8291–8299.
Yang, Q. and Defoirdt, T. (2015) Quorum sensing positively regulates fagellar motility in pathogenic Vibrio harveyi. Environmental Microbiology 17, 960–968.
Yang, Q., Pande, G.S.J., Wang, Z., Lin, B., Rubin, R.A., Vora, G.J., and Defoirdt, T. (2017) Indole ignaling and (micro) algal auxins decrease the virulence of Vibrio campbellii, a major pathogen of aquatic organisms. Environmental Microbiology 19, 1987–2004.
Yao, Z., Yang, K., Huang, L., Huang, X., Qiuqian, L., Wang, K., and Zhang, D. (2018) Disease outbreak accompanies the dispersive structure of shrimp gut bacterial community with a simple core microbiota. AMB Express 8, 120.
Yu, W., Wu, J.-H., Zhang, J., Yang, W., Chen, J., and Xiong, J. (2018) A meta-analysis reveals universal gut bacterial signatures for diagnosing the incidence of shrimp disease. FEMS Microbiology Ecology 94, fy147.
Zhang, D., Wang, X., Xiong, J., Zhu, J., Wang, Y. Zhao, Q., Chen, H., Guo, A., Wu, J., and Dai, H. (2014) Bacterioplankton assemblages as biological indicators of shrimp health status. Ecological Indicators 38, 218–224.
Zhang, M., Pan, L., Huang, F., Gao, S., Su, C., Zhang, M., and He, Z. (2019) Metagenomic analysis of composition, function and cycling processes of microbial community in water, sediment and efuent of Litopenaeus vannamei farming environments under diferent culture modes. Aquaculture 506, 280–293.
Zheng, Y., Yu, M., Liu, J., Qiao, Y., Wang, L., Li, Z., Zhang, X.-H., and Yu, M. (2017) Bacterial community associated with healthy and diseased Pacifc white shrimp (Litopenaeus vannamei) larvae and rearing water across diferent growth stages. Frontiers in Microbiology 8, 1362.
Zheng, Y. Yu, M., Liu, Y., Su, Y., Xu, T., Yu, M., and Zhang, X.-H. (2016) Comparison of cultivable bacterial communities associated with Pacifc white shrimp (Litopenaeus vannamei) larvae at diferent health statuses and growth stages. Aquaculture 451, 163–169.
Zhu, J., Dai, W., Qiu, Q., Dong, C., Zhang, J., and Xiong, J. (2016) Contrasting ecological processes and functional compositions between intestinal bacterial community in healthy and diseased shrimp. Microbial Ecology 72, 975–985.
Zoqratt, M.Z.H.M., Eng, W.W.H., Tai, B.H., Austin, C.M., and Gan, H.M. (2018) Microbiome analysis of Pacifc white shrimp gut and rearing water from Malaysia and Vietnam: implications for aquaculture research and management. PeerJ 6, e5826.


