ویروسی جدید از خانواده Marnaviridae به عنوان یک پاتوژن بالقوهی بیماری پست لاروهای شیشهای Penaeus vannamei

ویروسی جدید از خانواده Marnaviridae[1] به عنوان یک پاتوژن بالقوهی بیماری پست لاروهای شیشهای Penaeus vannamei
- چکیده
- مقدمه
- مواد و روشها
- جمع آوری و تحلیل نمونه
- شکل 1
- استخراج اسید نوکلئیک و مطالعات کتابخانهای.
- تجزیه و تحلیل بیوانفورماتیک..
- تست چالش..
- نتایج.
- علائم بالینی.
- کشف Baishivirus ویروس..
- شکل 2.
- شکل 3.
- شکل 4.
- بحث..
- نتیجه گیری.
چکیده
میگوی وانامی به عنوان یک آبزی با اهمیت تجاری، در حال حاضر گونه غالب میگوی پرورشی در چین و بسیاری از کشورهای دیگر در سراسر جهان است. در سالهای اخیر، شیوع بیماری پست لارو شیشهای (glass post-larvae disease ,GDP) که بیش از 90 درصد از مرگ و میر لاروهای میگو را در موارد جدی تشکیل می دهد، در بسیاری از مناطق چین باعث خسارات قابل توجهی شده و پایداری صنعت آبزی پروری را به خطر انداخته و تعیین عامل عفونی بیماری GPD در P. vannamei بسیار ضروری است. در این کار، ما توالییابی متاژنومیک پست لارو شیشهای جمعآوری شده از میگوهای بیمار در استان تانگشان هبی، جایی که اخیراً GPD در آن شیوع پیدا کرد، انجام دادیم. یک درخت تکاملی توسط MEGA7[2] برای درک تاریخچه تکاملی و رابطه ژنوم پاتوژن ساخته شد. یک ویروس جدید از خانواده Marnaviridae برای اولین بار در P. vannamei آلوده به بیماری GPD شناسایی شد و ما به طور آزمایشی این ویروس را (GenBank: ON550424) Baishivirus نامیدیم. پاتوژن شناسایی شده بر اساس قانون کخ [3]و با سنجش چالش بیماری زایی معکوس، اعتبارسنجی شد. واکنش زنجیرهای رونویسی-پلیمراز نشان داد که ویروس بایشی تنها 8 درصد شباهت با 64.96 درصد هویت در ژنوم در مقایسه با نزدیکترین توالی ژنومی ویروس شبه پیکورنای Wenzhou 21 گزارش شده در سال 2016 دارد. RNA ژنومی بایشی ویروس 9.895 کیلوبایت طول دارد و سه بخشی از توالی mRNA (ORFs[4]) را کد می کند. شناسایی Baishivirus در P. vannamei خانواده Marnaviridae بسیار مورد اهمیت است و به طور بالقوه این مطالعه یک نامزد جدید برای مطالعه و جلوگیری از GPD در صنعت آبزی پروری را فراهم می کند.
مقدمه
پرورش P. vannamei بخش مهمی از آبزی پروری است که به توسعه اقتصاد جهانی کمک زیادی می کند. تولیدکنندگان عمده عبارتند از چین، هند، اکوادور، اندونزی و ویتنام (شکل 1A). در سال 2020، تولید جهانی P. vannamei 5.82 میلیون تن برآورد شده و نرخ رشد سالانه، 2.15٪ کاهش یافت. بیماری P. vannamei یکی از دلایل اصلی این کاهش تولید است که عمدتاً ناشی از عفونتهای ویروسی و باکتریایی است. برای مقاومت در برابر عفونت باکتریایی میتوان از استراتژیهایی مانند استفاده از عوامل ضد باکتریایی استفاده کرد. عفونتهای ویروسی معمولاً خسارات زیادی به صنعت پرورش میگو وارد میکنند که توجه محققان را به خود جلب کرده است. بسیاری از DNA ویروسها اثرات جدی بر روی میگو دارند، مانند ویروس سندرم لکه سفید (WSSV)، باکولوویروس نوع مونودون (MBV)، ویروس نکروز عفونی هیپودرمال و خونساز (IHHNV)، پاروویروس کبدی پانکراس (HPV)، ویروس رنگین کمانی هموسیت میگو (SHIV)، ویروس سندرم تائورا، ویروس مرگ و میر جدا شده از تخمگذار (SMV)، ویروس لنفوئیدی پارو مانند (LPV)، باکولوویروس پنای (BP) و باکولوویروس ویروس نکروز غده میانی روده (BMNV). RNA ویروس ها در پرورش میگو عمدتاً شامل ویروس میونکروز عفونی (IMNV)، پنائوس وانامی نوداویروس (PvNV)، ماکروبراکیوم روزنبرگی نوداویروس (MrNV)، نوداویروس مرگ و میر مخفی (CMNV)، ویروس Laem-Singh (LSNV)، ویروس کله زرد (YHV) ویروس مرتبط با آبشش (GAV) و ویروس سندرم تاورا (TSV). هر دو ویروس IMNV و PvNV میتوانند P. vannamei را آلوده کنند و باعث نکروز عضلانی شوند. CMNV که توسط تیم ژانگ شناسایی شد، با یک بیماری کشنده مغلوب در میگو مرتبط است و باعث تلفات شدید در چین و برخی از کشورهای جنوب آسیا شده است. TSV برای اولین بار در سال 1992 در P. vannamei کشف شد و عامل بروز سندروم بیماری تورا در میگو است که برای چندین دهه بر صنعت پرورش میگو تأثیر گذاشته است. شناسایی و پی بردن به صفات اختصاصی عوامل بیماریزا در صنعت پرورش میگو برای کاهش خسارات اقتصادی با پیشگیری و کنترل بیماری میگو بسیار با اهمیت است. بیماری پست لارو شیشه ای (glass post-larvae disease ,GDP) ناشی از یک عامل بسیار عفونی و بیماریزا است. هنگامی که تعداد کمی از لاروهای میگو علائم GPD را داشته باشند، تقریباً همه لاروهای میگویی که در همان حوضچه قرار دارند ممکن است در عرض 24 ساعت به این بیماری مبتلا شوند. اخیراً، GPD تعداد زیادی P. vannamei را در استان هبی، شمال چین را آلوده کرده است که منجر به مرگ و میر انبوه میگو و خسارات اقتصادی زیادی شده است. زو و همکاران با موفقیت یک سویه از Vibrio parahaemolyticus را جدا کردند و نشان داده شده که این عامل بسیار بیماری زا بوده و با بیماری پست لارو شیشه ای مرتبط است. با این حال، V. parahaemolyticus شناسایی شده در تحقیقات ما، علت GPD نبود. در اینجا، ما یک ویروس جدید از خانواده Marnaviridae را به عنوان یک پاتوژن بالقوه GPD شناسایی کردیم و نام آن را Baishivirus گذاشتیم. این کار نه تنها یکی از اعضای جدید خانواده Marnaviridae را شناسایی میکند، بلکه بینش جدیدی در مورد تحقیقات GPD در صنعت آبزیپروری P. vannamei ارائه میدهد.
مواد و روشها
جمع آوری و تحلیل نمونه
لاروهای میگو (مرحله 7 و 8) مورد استفاده در آزمایش از مزارع پرورش (شکل 1B) در شهر تانگشان، استان هبی جمع آوری شد، جایی که 80 درصد از لاروهای میگو علائم GPD را نشان دادند. نمونه ها پس از انتقال به آزمایشگاه روی یخ خشک، ذوب و سه بار در اتانول 70 درصد شسته و سپس با آب استریل دیونیزه شسته شدند تا آلاینده های محیطی حذف شوند.
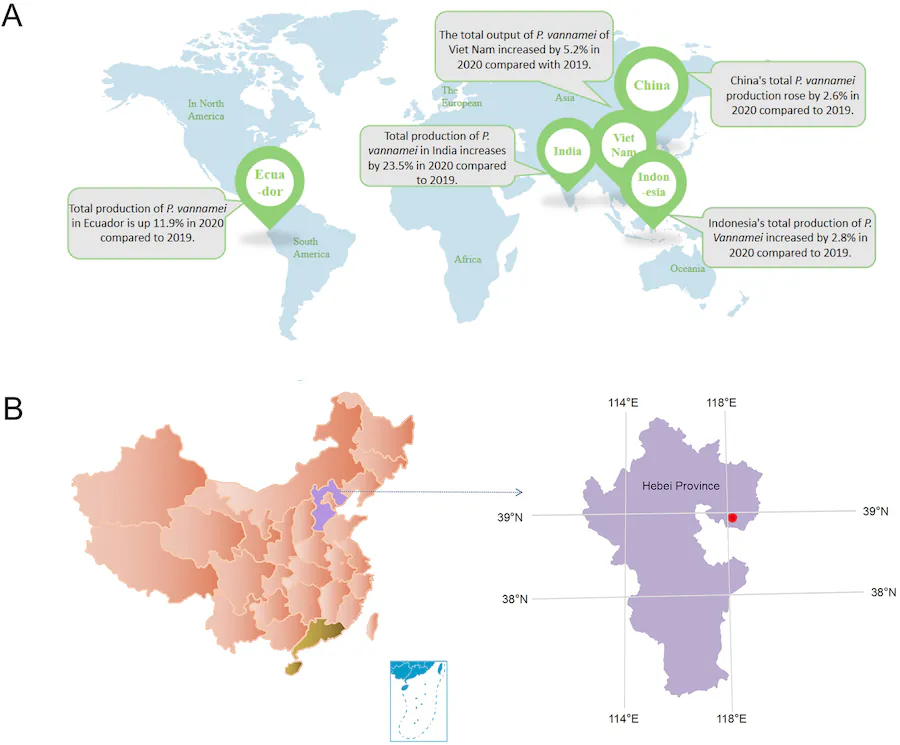
شکل 1. پراکندگی کشورهای عمده تولید کننده P. vannamei در جهان و مکانهای جمع آوری نمونه در این مطالعه. (الف) کشورهای عمده تولید کننده P. vannamei در جهان. کل تولید جهانی P. vannamei در سال 2020 تقریباً 5.82 میلیون تن بوده است. (تولید کنندگان عمده P. vannamei در سال 2020 از بالا به پایین چین، هند، اکوادور، اندونزی و ویتنام هستند). (ب) محل جمع آوری نمونه های P. vannamei. (استان های گوانگدونگ و هاینان با رنگ زرد، استان هبی با رنگ بنفش و شهر تانگشان با رنگ قرمز مشخص شدهاند.)
تقریباً 1 گرم از لارو میگو در آسیاب منجمد با فرکانس 70 هرتز به مدت 60 ثانیه آسیاب شد. هموژن در 12000 × گرم به مدت 10 دقیقه در دمای 4 درجه سانتیگراد سانتریفیوژ شد. مایع رویی هر نمونه با فیلتر 0.45 میکرومتر Pellicon II (Millipore, Billerica, MA, USA) فیلتر شد. فیلتر قبل از استخراج اسید نوکلئیک و آزمایش چالش در دمای 80 درجه سانتیگراد نگهداری شد.
استخراج اسید نوکلئیک و مطالعات کتابخانهای
اسیدهای نوکلئیک ویروسی بسیار خالص شده از مایع رویی فیلتر شده با استفاده از کیت اسید نوکلئیک ویروسی با خلوص بالا (روش، سوئیس) مطابق دستورالعمل ارائه شده توسط سازنده استخراج شدند. پس از تعیین کمیت با کیت سنجش RNA کیوبیت (Thermo Fisher Scientific, Inc.)، RNA استخراج شده با استفاده از Hifair II 1st Strand cDNA Synthesis SuperMix برای (gDNA digester plus) qPCR به cDNA رونویسی معکوس انجام شد. کیت سنجش کیوبیت (Thermo Fisher Scientific, Inc.) dsDNA HS برای تعیین محتوای cDNA روی یک نورسنج فلورسانس Qubit 4.0 (Thermo Fisher Scientific, Inc.) استفاده شد.
تجزیه و تحلیل بیوانفورماتیک
خوانشهای بیکیفیت برای رسیدن به دادههای با کیفیتتر حذف شدند. پاک کردن دادهها با استفاده از برنامه های NCBI blastn و blastx با پایگاه داده پروتئین غیر زائد (nr) و پایگاه داده نوکلئوتیدی غیر زائد (NT) مقایسه شدند. دادههای با کیفیت با استفاده از SPAdes نسخه 3.13.0 برای به دست آوردن توالی ژنوم کامل جمعآوری شدند. توالی ویروسی با استفاده از سرور RAST آنلاین حاشیهنویسی شد و فریمهای خواندن باز احتمالی (ORFs) با استفاده از blastx تأیید شد. ابزار جستجوی (https://www.genome.jp/tools/motif/)MOTIF برای تجزیه و تحلیل موتیفهای[5] پروتئینی ویروس استفاده شد. برای به دست آوردن فراوانی ژنومی، یک روش نقشه در CLC Genomics Workbench 12/0/1 (Qiagen، آلمان) استفاده شد. درخت تکاملی اسید آمینه مبتنی بر پروتئین با استفاده از برنامه MEGA 7 ساخته شد. توپولوژی درختی با تجزیه و تحلیل بوت استرپ با استفاده از روش همسایگی با پارامترهای پیش فرض 1000 تکرار ارزیابی شد.
تست چالش
لاروهای P. vannamei سالم از مزرعه میگو در Cangzhou، استان هبی تهیه شد و قبل از استفاده در آزمون چالش به مدت 2 روز دوره آداپتاسیون را گذراندند. 60 عدد P. vannamei به دو گروه آزمایش و یک گروه کنترل هر کدام با 20 میگو تقسیم شدند. میگوهای گروههای آزمایشی در مخلوطی از 3 میلی لیتر مایع رویی فیلتر شده (20738 copies /μL Baishivirus در S1 و 46663 copies /μL Baishivirus در S2′) (S1’، S2′: نمونه های GPD اولیه) و 27 میلی لیتر PBS غوطه ور شدند. به مدت 10 دقیقه در گروه شاهد، 20 میگو در 30 میلی لیتر PBS به مدت 10 دقیقه حمام داده شدند. میگوهای غوطهور شده و PBS به 1 لیتر آب اکسیژنه منتقل شده و به مدت 5 روز تغذیه شدند. مرگ و میر میگو و تغییرات مورفولوژیکی ثبت شد. پس از اینکه میگوهای مرده خارج شدند، آنها را به صورت جداگانه در کیسه های مشخص شده با نام گروه و زمان مهر و موم کردند و قبل از تهیه نمونه برای RT‒ PCR در دمای 2 تا 8 درجه سانتیگراد نگهداری شدند. برای تایید توالی ژنوم پاتوژن های مونتاژ شده توسط توالی یابی متاژنومی، پرایمرهایی توسط SnapGene طراحی شد و اندازه قطعه ژن ORF2 ، و هدف 131 جفت باز بود. پرایمر بالادست F: TGTGGAAGTCCAGCCATAAC، پرایمر پایین دست
R: AGCTGGGTTTCTCCTTCTTG، و پروب: TGGGAGTGGCAAACGCCATTACTT استفاده شد. قطعه با استفاده از کیت One Step TB Green™ PrimeScript™ RT‒PCR (TAKARA، کد شماره RR066A) تکثیر شد. شرایط واکنش به شرح زیر بود: یک چرخه 42 درجه سانتیگرادی برای 5 دقیقه، 95 درجه سانتیگراد برای 10 ثانیه و 40 چرخه 95 درجه سانتیگراد برای 5 ثانیه، 60 درجه سانتیگراد برای 34 ثانیه. پاتوژنها با استفاده از یک کیت بسیار خاص و حساس که توسط آزمایشگاه ما طراحی شده است، تأیید شدند، که به طور مشخص استخراج اسید نوکلئیک و LAMP بصری (تقویت همدما با واسطه حلقه) را ترکیب میکند.
نتایج
علائم بالینی
در آوریل 2021، GPD به طور ناگهانی در مزارع P. vannamei در تانگشان، استان هبی رخ داد. علائم بالینی اولیه GPD شامل عدم تغذیه، حرکات کند و ضعیف، کنش کند، پاسخ آهسته به تحریک خارجی، آبشش میگو زرد کم رنگ و تغییر رنگ بافت پانکراس کبد از قهوه ای کامل به قهوه ای روشن است. تقریباً 24 تا 48 ساعت بعد، میگو علائم بیشتری مانند خالی بودن ژژونوم و معده، رشته های آبشش متورم و شل، طرح کلی هپاتوپانکراس نکروزه و رنگ پریده، و ناحیه نازک و کدر از تیموس تا شکم را بروز داد. بدن میگو در حال مرگ سفید و شفاف می شود، با آتروفی عضلانی، شکنندگی و فرسایش بافت آبشش، نکروز و رنگ پریدگی هپاتوپانکراس، انحطاط شیشه ای ژژنوم و معده خالی (شکل 2).
کشف ویروس
پس از آسیاب شدن میگوهای دارای GPD، مایع رویی برای تعیین توالی متاژنومی جمع آوری شد تا عوامل بیماری زای بالقوه شناسایی شوند. بر اساس گزارش Blastx، 111 کانتیگ مربوط به ویروس 21 شبیه Wenzhou Picorna که فراوان ترین دسته بود، به دست آمد. پس از مونتاژ denovo، یک توالی ژنومی ویروس شبیه پیکورنای جدید با 9859 جفت باز بدست آمد که با پوشش بالای کل توالی ژنوم تایید شد (شکل S1). تنها 64.96 درصد هویت بیش از 8 درصد پوشش در مقایسه با نزدیکترین ویروس ونژو picorna مانند 21(GenBank: KX884351.1) در سال 2016 گزارش شده بود، و ما پاتوژن تازه شناسایی شده را Baishivirus نامیدیم. سه فریم خواندن باز (ORFs) در بایشی ویروس پیشبینی شد: ORF1، ORF2، و ORF3 که پروتئینهایی با طولهای 76 aa، 1995 aa و 877 aa را کد میکنند. علاوه بر Baishivirus، سه پاتوژن دیگر با توالییابی متاژنومیک کشف شد: pico1 (ویروس میگو ونژو 8)، VP (Vibrio parahaemolyticus) و
VC (Vibrio campbellii).
ما نمونههای اولیه GPD شناور روی سطح را (ویروس در تئوری) و رسوب (باکتری در تئوری) جدا کردیم و این پاتوژنها را با RT‒PCR شناسایی کردیم. Pico1 هم در گروه آزمایش (میگوی بیمار) و هم در گروه کنترل (میگوی سالم) وجود داشت که نشان میدهد pico1 علت بیماری نبوده است (شکل 3).
آزمایشهای چالشی برای برآورده کردن فرضیات کخ انجام شد. پس از اینکه میگوهای سالم را با مایع رویی به چالش کشیدیم، میگوهای گروه آزمایش علائم GPD را در 24 تا 48 ساعت نشان دادند و همه میگوها در روز چهارم آزمایش تلف شدند، در حالی که میگوهای گروه کنترل طبیعی بودند. مقادیر Ct Baishivirus در دو نمونه اصلی GPD S1′ و S2′ به ترتیب 25.66 و 24.49 بود و مقدار Ct Baishivirus در نمونه کنترل غیرقابل تشخیص بود (شکل 3). پس از چالش با نمونه GPD، مقادیر Ct ویروس Baishivirus در نمونه های آلوده S1 و S2 (S1, S2: میگو آلوده به مایع رویی اولیه) به ترتیب 31.565 و 33.701 بود و مقدار Ct در گروه کنترل غیرقابل تشخیص بود. در مقابل، نه VC و نه VP در نمونه میگوی آلوده با RT‒PCR با چالش رسوب شناسایی نشدند، و نقش آنها در GPD (S3 و S4 در شکل 3) رد شد (S3، S4: میگوهای آلوده به رسوب اولیه). نتایج نشان داد که Baishivirus در نمونه های GPD وجود دارد و احتمالاً P. vannamei طبیعی را با GPD آلوده می کند.
تجزیه و تحلیل فیلوژنتیک
ساخت مجموعه RNA برای نمونههای S1′ و S2′ GPD به ترتیب 4.7 G و 8 G داده تولید کرد. مونتاژ Denovo از طریق SPAdes v3.13.0 برای بدست آوردن توالی ژنوم کامل Baishivirus انجام شد. موتیف های پروتئینی ORF های Baishivirus توسط ابزار جستجوی MOTIF تجزیه و تحلیل شدند و موتیف های پروتئینی متعدد همانطور که نشان داده شد پیش بینی شدند (شکل 4A و 4B).

شکل 2. علائم بالینی P. vannamei آلوده به بیماری پست لارو شیشهای (GPD) در مقایسه با میگوهای معمولی. همانطور که در گوشه سمت چپ پایین تصویر نشان داده شده است، فلش سیاه نشان دهنده میگوهای معمولی و فلش قرمز نشان دهنده میگوهای بیمار است.
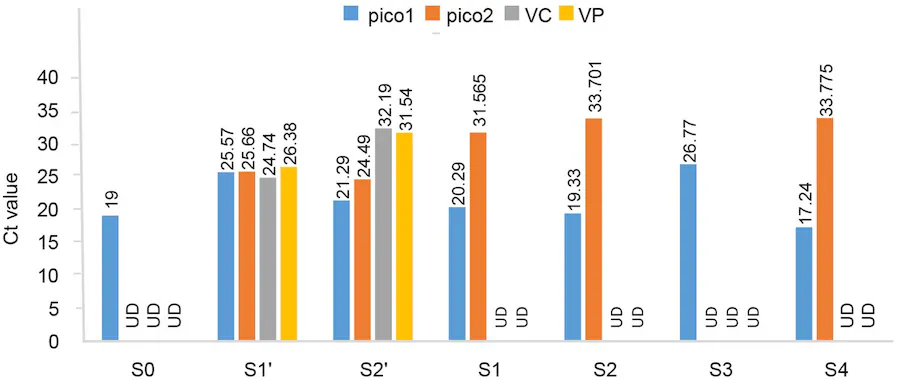
شکل 3. مقادیر Ct RT‒PCR در آزمایش چالش. S0: نمونه شاهد، S1’، S2′: نمونه های اولیه GPD، S1، S2: میگو آلوده به مایع اولیه سطح بالایی ، S3، S4: میگوی آلوده به رسوب اولیه. Pico1: ویروس میگویWenzhou 8، pico2: Baishivirus، VP: Vibrio parahaemolyticus، VC: Vibrio campbellii. UD: غیر قابل کشف
درخت فیلوژنتیک توالی اسید آمینه بایشی ویروس ابتدا بر اساس کپسیدها ساخته شد (شکل 4C). اعضای هشت خانواده در راسته Picornavirales، یعنی Caliciviridae، Dicistroviridae، Iflaviridae، Marnaviridae، Picornaviridae، Polycipiviridae، Secoviridae، و Solinviviridae، برای ساختن درخت تکاملی انتخاب شدند. در درخت تکاملی، Baishivirus به ویروس ونژو picorna مانند 21 (GenBank KX884351.1) که در سال 2016 شناسایی شد (در سال 2018 به روز شد) نزدیکترین است. هم Baishivirus ویروس و هم ویروس شبه پیکورنای ونژو 21 (KX884351.1) به اعضای خانواده Marnaviridae نزدیک تر بودند، که نشان می دهد احتمالاً به خانواده Marnaviridae تعلق دارند.
خانواده Marnaviridae را می توان از خانواده های دیگر در ردیف Picornavirales با دنباله RdRP متمایز کرد. یک درخت فیلوژنتیک بر اساس توالی Baishivirus RdRP برای بررسی بیشتر روابط تکاملی Baishivirus ساخته شد (شکل 5).
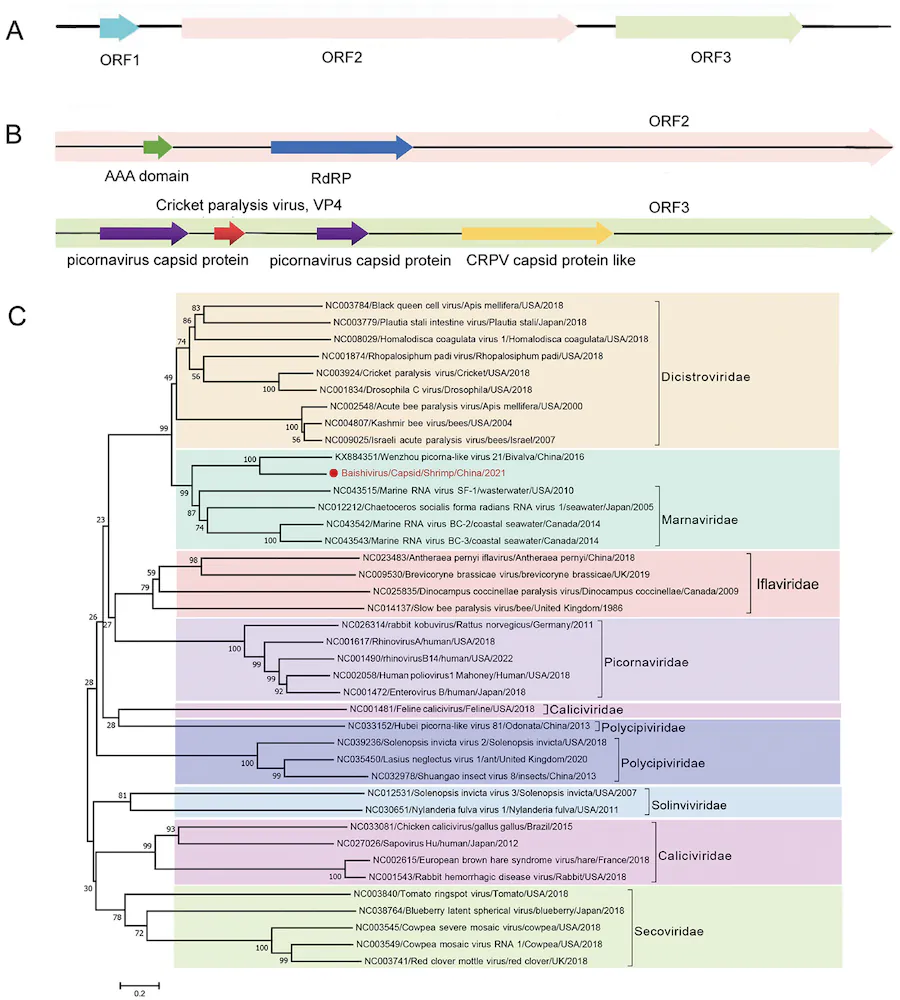
شکل 4. درخت فیلوژنتیک Baishivirus بر اساس اسیدهای آمینه کدگذاری شده توسط کپسید. (الف) نمودار شماتیک ساختار ژنوم بایشی ویروس. (ب) نقوش پروتئین Baishivirus ORF2 و ORF3 توسط جستجوی MOTIF تجزیه و تحلیل شد. (C) تجزیه و تحلیل همولوژی توالی اسید آمینه کدگذاری شده توسط کپسید (نقطه قرمز و فونت نشان دهنده Baishivirus).
همانطور که در درخت فیلوژنتیک نشان داده شده است، Baishivirus نزدیکترین اعضای خانواده Marnaviridae و Dicistroviridae بود. در نتیجه، یک درخت فیلوژنتیک بر اساس توالی RdRP با دربر گرفتن همه اعضای Marnaviridae و Dicistroviridae ساخته شد (شکل S2). ما اعضای Secoviridae را به عنوان گروه های بیرونی درخت انتخاب کردیم تا روابط تکاملی را بهتر درک کنیم. Baishivirus وWenzhou picorna-like virus (KX884351.1) شاخه جدیدی از Marnaviridae را تشکیل دادند. درخت تکاملی مبتنی بر RdRP همچنین تأیید می کند که Baishivirus یک ویروس جدید در خانواده Marnaviridae در راسته Picornavirales است. علاوه بر این، Baishivirus و Wenzhou virus 21 احتمالاً یک جنس جدید از خانواده Marnaviridae را تشکیل می دهند که ما به طور آزمایشی آن را Baishivirus نامیدیم.
بحث
به عنوان یک محصول صادراتی مهم ، P. vannamei در سراسر جهان بسیار محبوب است، زیرا نه تنها توسعه اقتصادی صنعت آبزی پروری چین را افزایش می دهد، بلکه جهانی شدن صنعت آبزی پروری را نیز ترویج می کند. در سال های اخیر، بیماریهای ویروسی و بیماریهای باکتریایی به طور مداوم در آبزی پروری پدیدار شده اند که ممکن است عوامل متعددی مانند عوامل جغرافیایی منطقه ای، عفونت ویروسی، عفونت باکتریایی و عوامل انسانی را درگیر کند. اپیدمی در پرورش P. vannamei باعث مرگ مداوم لارو میگو و بحران بزرگی برای صنعت پرورش میگو شده است. تعیین دقیق پاتوژن نیاز حیاتی در پرورش میگو بوده و برای درمان تخصصی بیماری مفید است. به عنوان مثال، برای جلوگیری از سندرم لکه سفید ناشی از WSSV، 30 ppm کلر برای کشتن میگوها و ناقلین آلوده توصیه می شود و تبادل آب باید به حداقل برسد تا از ورود ناقلان ویروس به حوضچه جلوگیری شود. اپیدمی (EHP) Enterocytozoon hepatopenaei در چندین کشور ظاهر شد که عامل آن میکروسپوریدینهای قارچی هستند. در این شرایط پیشنهاد می شود مواد آلی انباشته شده در کف استخر به صورت فیزیکی حذف شود و امنیت زیستی باید در هچری تضمین شود. برای بیماری نکروز حاد هپاتوپانکراس (AHPND) ناشی از ویبریو پاراهمولیتیکوس، میزان تغذیه به شدت کنترل می شود و تراکم مناسب برای جلوگیری از بروز بیماری پیشنهاد می شود. اگرچه علائم بالینی ناخوشایند بیماری پست لارو شیشه ای (GPD) تا حدی شبیه به علائم سندرم AHPND است، اما GPD یک بیماری جدید با عوامل عفونی مختلف است. Baishivirus جدید در خانواده Marnaviridae که در این مقاله گزارش شده است بینش جدیدی در مورد مطالعه GPD در صنعت آبزی پروری P. vannamei ارائه می دهد. هیستوپاتولوژی با میکروسکوپ الکترونی باید در مطالعات بیشتر برای اثبات نقش غالب Baishivirus در بروز GPD استفاده گردد.
ویروس های حاوی رشته RNA مثبت یوکاریوت ها را می توان به سه ابرخانواده تقسیم کرد: خانواده های picorna مانند، آلفا مانند و شبه فلاوی. اعضای متعلق به ابرخانواده picorna مانند با RdRP، یک پروتئاز شبیه کیموتریپسین، یک ابرخانواده هلیکاز 3 (S3H) و پروتئین های ویروسی (VPs) مشخص می شوند. به طور کلی، این ویروس ها دارای ویریون های ایکوساهدرال هستند که از پروتئین های کپسید تشکیل شده اند. به عنوان اعضای ابرخانواده شبیه پیکورنا، طبقه بندی ویروس Marnaviridae در سال 2021 به ICTV شناخته شد.
Marnaviridae یک ویریون بدون پوشش، 22-35 نانومتر با چهار پروتئین ساختاری (VP1-4) بر روی سطح است. پروتئینهای غیرساختاری در انتهای 5 و پروتئینهای ساختاری در انتهای 3 کدگذاری میشوند. از آنجایی که ویژگی ژن در این خانواده شبیه به برخی از اعضای Picornaviridae است، تجزیه و تحلیل فیلوژنتیکی توالیهای اسید آمینه RdRP Marnaviridae برای متمایز کردن آن از سایر خانوادهها پیشنهاد میشود. در حال حاضر، در مجموع 7 جنس متعلق به Marnaviridae هستند: Bacillarnavirus، Kusarnavirus، Labyrnavirus، Locarnavirus، Marnavirus، Salisharnavirus و Sogarnavirus. ژن ویروسی در سیتوزول تکثیر می شود و دوره های نهفته بین 8 تا 48 ساعت است. جداسازی ذرات ویروس خالص شده، ویژگی های ساختار و مکانیسم تکثیر Baishivirus را بیشتر روشن می کند.
نمونههای P. vannamei آلوده به GPD با توالییابی متاژنومیک مورد تجزیه و تحلیل قرار گرفتند تا یک پاتوژن جدید در GPD به نام Baishivirus آشکار شود.
مقایسه توالی پروتئین اعضای مختلف ابرخانواده ویروسی شبیه پیکورنا نشان داد که Baishivirus به احتمال زیاد عضوی از Marnaviridae است. به دلیل شباهت نسبتا کم با اعضای شناخته شده Marnaviridae، ما پیشنهاد می کنیم که Baishivirus یک ویروس جدید در Marnaviridae است. Baishivirus و Wenzhou picorna-like 21 احتمالاً نشان دهنده یک جنس جدید در خانواده Marnaviridae هستند که ما به طور آزمایشی آن را Baishivirus نامیدیم. با این حال، نمیتوانیم این احتمال را که هر دو ویروس Baishivirus و Wenzhou picorna-like 21 در ردیف Picornavirales طبقهبندی نشدهاند را کاملاً رد کنیم، که ممکن است خانواده جدیدی را تشکیل دهند. به طور کلی، کشف Baishivirus خانواده دریایی Marnaviridae را کامل می کند و مطالعات تکاملی و بیشتری را نیاز دارند.
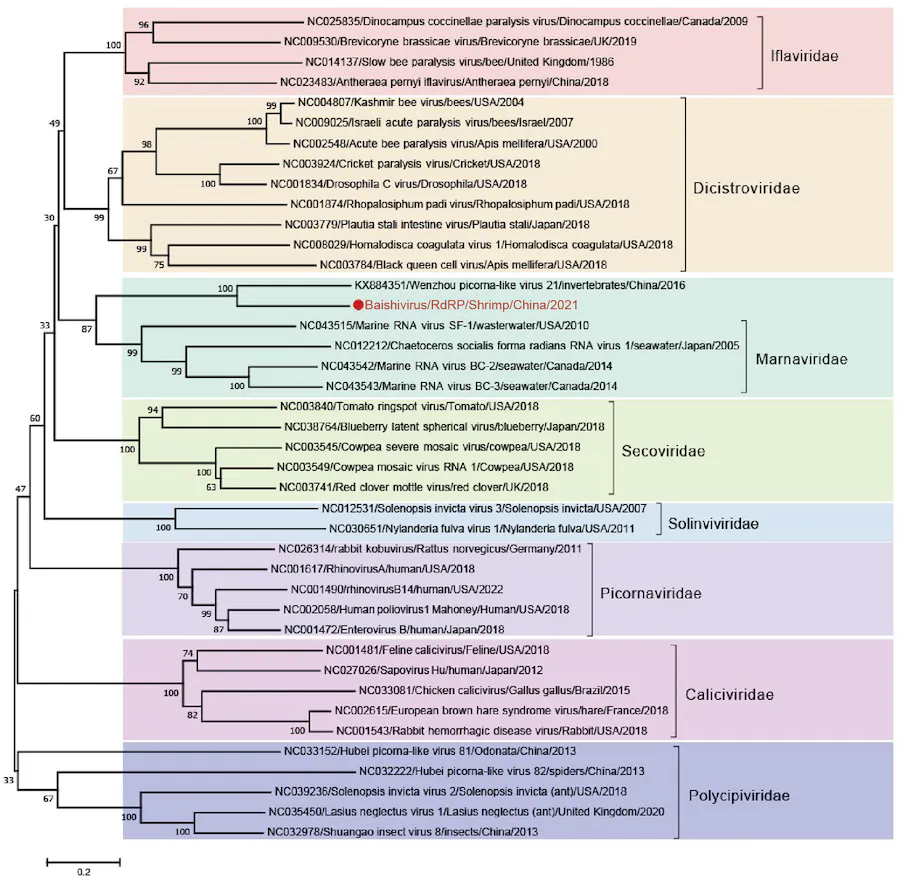
شکل 5. درخت فیلوژنتیک Baishivirus بر اساس اسیدهای آمینه رمزگذاری شده توسط RdRP (نقطه قرمز و فونت نشان دهنده Baishivirus) است.
نتیجه گیری
مزارع پرورش میگوی وانامی ارزش اقتصادی بالایی دارند و باعث جهانی شدن تجارت در صنعت آبزی پروری می شوند. انواع پاتوژن ها در گونههای مختلف آبزیان طبیعی یا پرورشی در مناطق مختلف در حال ظهور هستند که قابل توجه است. این مطالعه یک Baishivirus جدید از Marnaviridae را در P. vannamei شناسایی کرد که احتمالاً نقش غالبی در شیوع GPD دارد. این نتایج آگاهی ما را از تنوع ویروسی افزایش میدهد و راهنمایی برای پرورش میگوی وانامی و همچنین اهمیت در پیشگیری از بیماریهای عفونی نوظهور در آبزی پروری را فراهم میکند. ظهور COVID-19 بشر را وارد دوران پس از اپیدمی کرده است. به طور مشابه، GPD تبدیل به “اپیدمی” برای صنعت پرورش میگو خواهد شد که در آن به تلاش های طولانی مدت برای مطالعه اقدامات پیشگیری و کنترل مربوطه نیاز است. پاتوژن، میزبان و محیط همگی باید در مطالعات بیشتر در نظر گرفته شوند. قرار است ایمنی زیستی برای مزارع جهانی آبزی پروری و کارخانه های فرآوری تضمین شود و به طور همزمان، فناوری تشخیص و پایش عوامل بیماری زا باید بهبود یابد تا در نهایت به هدف کنترل و پیشگیری از بیماری دست یافت.


